+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Ab initio structure of triclinic lysozyme from electron-counted MicroED data | |||||||||
 マップデータ マップデータ | Ab initio normalized structure factor map of P1 lysozyme after fragment placement and density modification from electron-counted MicroED data | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Hydrolase | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Lactose synthesis / Antimicrobial peptides / Neutrophil degranulation / beta-N-acetylglucosaminidase activity / cell wall macromolecule catabolic process / lysozyme / lysozyme activity / defense response to Gram-negative bacterium / killing of cells of another organism / defense response to Gram-positive bacterium ...Lactose synthesis / Antimicrobial peptides / Neutrophil degranulation / beta-N-acetylglucosaminidase activity / cell wall macromolecule catabolic process / lysozyme / lysozyme activity / defense response to Gram-negative bacterium / killing of cells of another organism / defense response to Gram-positive bacterium / defense response to bacterium / endoplasmic reticulum / extracellular space / identical protein binding / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 電子線結晶学 / クライオ電子顕微鏡法 | |||||||||
 データ登録者 データ登録者 | Martynowycz MW / Clabbers MTB | |||||||||
| 資金援助 |  米国, 2件 米国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Methods / 年: 2022 ジャーナル: Nat Methods / 年: 2022タイトル: Ab initio phasing macromolecular structures using electron-counted MicroED data. 著者: Michael W Martynowycz / Max T B Clabbers / Johan Hattne / Tamir Gonen /  要旨: Structures of two globular proteins were determined ab initio using microcrystal electron diffraction (MicroED) data that were collected on a direct electron detector in counting mode. Microcrystals ...Structures of two globular proteins were determined ab initio using microcrystal electron diffraction (MicroED) data that were collected on a direct electron detector in counting mode. Microcrystals were identified using a scanning electron microscope (SEM) and thinned with a focused ion beam (FIB) to produce crystalline lamellae of ideal thickness. Continuous-rotation data were collected using an ultra-low exposure rate to enable electron counting in diffraction. For the first sample, triclinic lysozyme extending to a resolution of 0.87 Å, an ideal helical fragment of only three alanine residues provided initial phases. These phases were improved using density modification, allowing the entire atomic structure to be built automatically. A similar approach was successful on a second macromolecular sample, proteinase K, which is much larger and diffracted to a resolution of 1.5 Å. These results demonstrate that macromolecules can be determined to sub-ångström resolution by MicroED and that ab initio phasing can be successfully applied to counting data. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_25184.map.gz emd_25184.map.gz | 10.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-25184-v30.xml emd-25184-v30.xml emd-25184.xml emd-25184.xml | 18.5 KB 18.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_25184.png emd_25184.png | 83 KB | ||
| Filedesc metadata |  emd-25184.cif.gz emd-25184.cif.gz | 5.6 KB | ||
| その他 |  emd_25184_additional_1.map.gz emd_25184_additional_1.map.gz emd_25184_additional_2.map.gz emd_25184_additional_2.map.gz | 25.6 MB 25.5 MB | ||
| Filedesc structureFactors |  emd_25184_sf.cif.gz emd_25184_sf.cif.gz | 1.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-25184 http://ftp.pdbj.org/pub/emdb/structures/EMD-25184 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25184 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25184 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_25184_validation.pdf.gz emd_25184_validation.pdf.gz | 540 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_25184_full_validation.pdf.gz emd_25184_full_validation.pdf.gz | 539.6 KB | 表示 | |
| XML形式データ |  emd_25184_validation.xml.gz emd_25184_validation.xml.gz | 4.3 KB | 表示 | |
| CIF形式データ |  emd_25184_validation.cif.gz emd_25184_validation.cif.gz | 4.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25184 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25184 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25184 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-25184 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7skwMC  7skxC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_25184.map.gz / 形式: CCP4 / 大きさ: 11 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_25184.map.gz / 形式: CCP4 / 大きさ: 11 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Ab initio normalized structure factor map of P1 lysozyme after fragment placement and density modification from electron-counted MicroED data | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 これらの図は立方格子座標系で作成されたものです | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X: 0.21136 Å / Y: 0.21333 Å / Z: 0.20631 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: 2mFo-dFc map of P1 lysozyme determined ab initio...
| ファイル | emd_25184_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | 2mFo-dFc map of P1 lysozyme determined ab initio by electron counted MicroED data | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
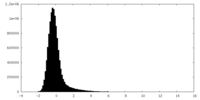
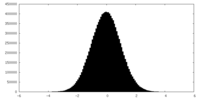
| 密度ヒストグラム |
-追加マップ: mFo-dFc map of P1 lysozyme determined ab initio...
| ファイル | emd_25184_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | mFo-dFc map of P1 lysozyme determined ab initio by electron counted MicroED data | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
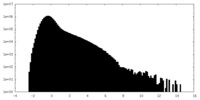
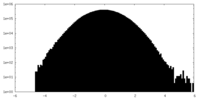
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Lysozyme
| 全体 | 名称: Lysozyme |
|---|---|
| 要素 |
|
-超分子 #1: Lysozyme
| 超分子 | 名称: Lysozyme / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 14.4 KDa |
-分子 #1: Lysozyme C
| 分子 | 名称: Lysozyme C / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: lysozyme |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 14.33116 KDa |
| 配列 | 文字列: KVFGRCELAA AMKRHGLDNY RGYSLGNWVC AAKFESNFNT QATNRNTDGS TDYGILQINS RWWCNDGRTP GSRNLCNIPC SALLSSDIT ASVNCAKKIV SDGNGMNAWV AWRNRCKGTD VQAWIRGCRL UniProtKB: Lysozyme C |
-分子 #2: NITRATE ION
| 分子 | 名称: NITRATE ION / タイプ: ligand / ID: 2 / コピー数: 4 / 式: NO3 |
|---|---|
| 分子量 | 理論値: 62.005 Da |
| Chemical component information |  ChemComp-NO3: |
-分子 #3: water
| 分子 | 名称: water / タイプ: ligand / ID: 3 / コピー数: 156 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 電子線結晶学 |
| 試料の集合状態 | 3D array |
- 試料調製
試料調製
| 濃度 | 5 mg/mL |
|---|---|
| 緩衝液 | pH: 4.7 |
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 10 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 30 sec. |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 95 % / チャンバー内温度: 277 K / 装置: LEICA PLUNGER |
| 詳細 | Milled microcrystals |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 77.0 K / 最高: 90.0 K |
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) デジタル化 - サイズ - 横: 2048 pixel / デジタル化 - サイズ - 縦: 2048 pixel / 撮影したグリッド数: 1 / 実像数: 1 / 回折像の数: 840 / 平均露光時間: 0.5 sec. / 平均電子線量: 0.001 e/Å2 詳細: 0.15 degrees per second, 0.5 second readout, 30 to -30 degrees |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: DIFFRACTION / Cs: 2.7 mm / カメラ長: 1202 mm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN / 傾斜角度: -30.0, 30.0 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 詳細 | Binned by 2 |
|---|---|
| 最終 再構成 | 解像度の算出法: DIFFRACTION PATTERN/LAYERLINES / ソフトウェア - 名称: REFMAC |
| Merging software list | ソフトウェア - 名称: AIMLESS |
| Crystallography statistics | Number intensities measured: 569407 / Number structure factors: 64974 / Fourier space coverage: 87.58 / R sym: 0.073 / R merge: 0.236 / Overall phase error: 30 / Overall phase residual: 0 / Phase error rejection criteria: None / High resolution: 0.87 Å / 殻 - Shell ID: 1 / 殻 - High resolution: 0.87 Å / 殻 - Low resolution: 0.9 Å / 殻 - Number structure factors: 2783 / 殻 - Phase residual: 30 / 殻 - Fourier space coverage: 37.64 / 殻 - Multiplicity: 2.1 |
-原子モデル構築 1
| 精密化 | 空間: RECIPROCAL / プロトコル: AB INITIO MODEL / 温度因子: 12.188 / 当てはまり具合の基準: Maximum likelihood |
|---|---|
| 得られたモデル |  PDB-7skw: |
 ムービー
ムービー コントローラー
コントローラー









 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)