+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-23960 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Norovirus T=3 GII.4 HOV VLP | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | T=3 Capsid GII.4 HOV Norovirus / VIRUS | |||||||||
| 機能・相同性 | Calicivirus coat protein C-terminal / Calicivirus coat protein C-terminal / Calicivirus coat protein / Calicivirus coat protein / Picornavirus/Calicivirus coat protein / Viral coat protein subunit / VP1 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Norovirus GII.4 (ウイルス) Norovirus GII.4 (ウイルス) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.8 Å | |||||||||
 データ登録者 データ登録者 | Salmen W / Hu L | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Atomic structure of the predominant GII.4 human norovirus capsid reveals novel stability and plasticity. 著者: Liya Hu / Wilhelm Salmen / Rong Chen / Yi Zhou / Frederick Neill / James E Crowe / Robert L Atmar / Mary K Estes / B V Venkataram Prasad /  要旨: Human noroviruses (HuNoVs) cause sporadic and epidemic viral gastroenteritis worldwide. The GII.4 variants are responsible for most HuNoV infections, and GII.4 virus-like particles (VLPs) are being ...Human noroviruses (HuNoVs) cause sporadic and epidemic viral gastroenteritis worldwide. The GII.4 variants are responsible for most HuNoV infections, and GII.4 virus-like particles (VLPs) are being used in vaccine development. The atomic structure of the GII.4 capsid in the native T = 3 state has not been determined. Here we present the GII.4 VLP structure with T = 3 symmetry determined using X-ray crystallography and cryo-EM at 3.0 Å and 3.8 Å resolution, respectively, which reveals unanticipated novel features. A novel aspect in the crystal structure determined without imposing icosahedral symmetry is the remarkable adaptability of the capsid protein VP1 driven by the flexible hinge between the shell and the protruding domains. In both crystal and cryo-EM structures, VP1 adopts a stable conformation with the protruding domain resting on the shell domain, in contrast to the 'rising' conformation observed in recent cryo-EM structures of other GII.4 VLPs. Our studies further revealed that the resting state of VP1 dimer is stabilized by a divalent ion, and chelation using EDTA increases capsid diameter, exposing new hydrophobic and antigenic sites and suggesting a transition to the rising conformation. These novel insights into GII.4 capsid structure, stability, and antigen presentation may be useful for ongoing vaccine development. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_23960.map.gz emd_23960.map.gz | 451.1 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-23960-v30.xml emd-23960-v30.xml emd-23960.xml emd-23960.xml | 14.9 KB 14.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_23960.png emd_23960.png | 224.3 KB | ||
| マスクデータ |  emd_23960_msk_1.map emd_23960_msk_1.map | 476.8 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-23960.cif.gz emd-23960.cif.gz | 5.5 KB | ||
| その他 |  emd_23960_half_map_1.map.gz emd_23960_half_map_1.map.gz emd_23960_half_map_2.map.gz emd_23960_half_map_2.map.gz | 442.1 MB 442.3 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-23960 http://ftp.pdbj.org/pub/emdb/structures/EMD-23960 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-23960 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-23960 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_23960_validation.pdf.gz emd_23960_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_23960_full_validation.pdf.gz emd_23960_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_23960_validation.xml.gz emd_23960_validation.xml.gz | 18.2 KB | 表示 | |
| CIF形式データ |  emd_23960_validation.cif.gz emd_23960_validation.cif.gz | 21.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23960 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23960 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23960 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-23960 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_23960.map.gz / 形式: CCP4 / 大きさ: 476.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_23960.map.gz / 形式: CCP4 / 大きさ: 476.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.24 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_23960_msk_1.map emd_23960_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
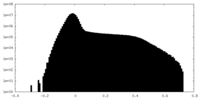
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_23960_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_23960_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Norovirus GII.4
| 全体 | 名称:  Norovirus GII.4 (ウイルス) Norovirus GII.4 (ウイルス) |
|---|---|
| 要素 |
|
-超分子 #1: Norovirus GII.4
| 超分子 | 名称: Norovirus GII.4 / タイプ: virus / ID: 1 / 親要素: 0 / 含まれる分子: #1 / NCBI-ID: 489821 / 生物種: Norovirus GII.4 / ウイルスタイプ: VIRUS-LIKE PARTICLE / ウイルス・単離状態: STRAIN / ウイルス・エンベロープ: No / ウイルス・中空状態: Yes |
|---|
-分子 #1: VP1
| 分子 | 名称: VP1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Norovirus GII.4 (ウイルス) Norovirus GII.4 (ウイルス) |
| 分子量 | 理論値: 58.760895 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: MKMASSDASP SDGSTANLVP EVNNEVMALE PVVGAAIAAP VAGQQNVIDP WIRNNFVQAP GGEFTVSPRN APGEILWSAP LGPDLNPYL SHLARMYNGY AGGFEVQVIL AGNAFTAGKI IFAAVPPNFP TEGLSPSQVT MFPHIIVDVR QLEPVLIPLP D VRNNFYHY ...文字列: MKMASSDASP SDGSTANLVP EVNNEVMALE PVVGAAIAAP VAGQQNVIDP WIRNNFVQAP GGEFTVSPRN APGEILWSAP LGPDLNPYL SHLARMYNGY AGGFEVQVIL AGNAFTAGKI IFAAVPPNFP TEGLSPSQVT MFPHIIVDVR QLEPVLIPLP D VRNNFYHY NQSNDPTIKL IAMLYTPLRA NNAGDDVFTV SCRVLTRPSP DFDFIFLVPP TVESRTKPFT VPILTVEEMT NS RFPIPLE KLFTGPSGAF VVQPQNGRCT TDGVLLGTTQ LSPVNICTFR GDVTHIAGTH DYTMNLASQN WNNYDPTEEI PAP LGTPDF VGKIQGVLTQ TTRGDGSTRG HKATVSTGSV HFTPKLGSVQ FTTDTNNDLE TGQNTKFTPV GVVQDGNSAH QNEP QQWVL PNYSGRTGHN VHLAPAVAPT FPGEQLLFFR STMPGCSGYP NMNLDCLLPQ EWVLHFYQEA APAQSDVALL RFVNP DTGR VLFECKLHKS GYVTVAHTGP HDLVIPPNGY FRFDSWVNQF YTLAPMGNGA GRRRAL UniProtKB: VP1 |
-分子 #2: water
| 分子 | 名称: water / タイプ: ligand / ID: 2 / コピー数: 5 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.96 mg/mL |
|---|---|
| 緩衝液 | pH: 6 |
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 3200FSC |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均露光時間: 10.0 sec. / 平均電子線量: 55.96 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.8 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cryoSPARC (ver. 2.15.0) 詳細: Using Cryosparc GSFSC, resolution calculated: No Mask = 4.2 A, Spherical = 4 A, Loose = 3.9 A, Tight = 3.8 A, corrected = 3.8 A 使用した粒子像数: 51913 |
| 初期 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC (ver. 2.15.0) |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC (ver. 2.15.0) |
 ムービー
ムービー コントローラー
コントローラー
















 Z
Z Y
Y X
X