[日本語] English
 万見
万見- EMDB-18127: S-layer of archaeon Sulfolobus acidocaldarius by subtomogram averaging -
+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | S-layer of archaeon Sulfolobus acidocaldarius by subtomogram averaging | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | S-layer / protein-protein interactions / protein-membrane interactions / STRUCTURAL PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |   Sulfolobus acidocaldarius (好気性・好酸性) Sulfolobus acidocaldarius (好気性・好酸性) | |||||||||
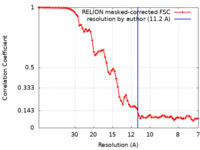
| 手法 | サブトモグラム平均法 / クライオ電子顕微鏡法 / 解像度: 11.2 Å | |||||||||
 データ登録者 データ登録者 | Gambelli L / McLaren MJ / Daum B | |||||||||
| 資金援助 | European Union, 1件
| |||||||||
 引用 引用 |  ジャーナル: Elife / 年: 2024 ジャーナル: Elife / 年: 2024タイトル: Structure of the two-component S-layer of the archaeon . 著者: Lavinia Gambelli / Mathew McLaren / Rebecca Conners / Kelly Sanders / Matthew C Gaines / Lewis Clark / Vicki A M Gold / Daniel Kattnig / Mateusz Sikora / Cyril Hanus / Michail N Isupov / Bertram Daum /     要旨: Surface layers (S-layers) are resilient two-dimensional protein lattices that encapsulate many bacteria and most archaea. In archaea, S-layers usually form the only structural component of the cell ...Surface layers (S-layers) are resilient two-dimensional protein lattices that encapsulate many bacteria and most archaea. In archaea, S-layers usually form the only structural component of the cell wall and thus act as the final frontier between the cell and its environment. Therefore, S-layers are crucial for supporting microbial life. Notwithstanding their importance, little is known about archaeal S-layers at the atomic level. Here, we combined single-particle cryo electron microscopy, cryo electron tomography, and Alphafold2 predictions to generate an atomic model of the two-component S-layer of . The outer component of this S-layer (SlaA) is a flexible, highly glycosylated, and stable protein. Together with the inner and membrane-bound component (SlaB), they assemble into a porous and interwoven lattice. We hypothesise that jackknife-like conformational changes in SlaA play important roles in S-layer assembly. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_18127.map.gz emd_18127.map.gz | 28.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-18127-v30.xml emd-18127-v30.xml emd-18127.xml emd-18127.xml | 18 KB 18 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_18127_fsc.xml emd_18127_fsc.xml | 7.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_18127.png emd_18127.png | 56.9 KB | ||
| Filedesc metadata |  emd-18127.cif.gz emd-18127.cif.gz | 5.8 KB | ||
| その他 |  emd_18127_half_map_1.map.gz emd_18127_half_map_1.map.gz emd_18127_half_map_2.map.gz emd_18127_half_map_2.map.gz | 15.5 MB 15.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-18127 http://ftp.pdbj.org/pub/emdb/structures/EMD-18127 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-18127 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-18127 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_18127_validation.pdf.gz emd_18127_validation.pdf.gz | 920.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_18127_full_validation.pdf.gz emd_18127_full_validation.pdf.gz | 920.4 KB | 表示 | |
| XML形式データ |  emd_18127_validation.xml.gz emd_18127_validation.xml.gz | 11.7 KB | 表示 | |
| CIF形式データ |  emd_18127_validation.cif.gz emd_18127_validation.cif.gz | 16.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-18127 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-18127 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-18127 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-18127 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_18127.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_18127.map.gz / 形式: CCP4 / 大きさ: 30.5 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 3.5 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_18127_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_18127_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Exosome
| 全体 | 名称: Exosome |
|---|---|
| 要素 |
|
-超分子 #1: Exosome
| 超分子 | 名称: Exosome / タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:   Sulfolobus acidocaldarius (好気性・好酸性) Sulfolobus acidocaldarius (好気性・好酸性)株: MW001 |
-分子 #1: SlaA S-layer
| 分子 | 名称: SlaA S-layer / タイプ: other / ID: 1 / 分類: other |
|---|---|
| 由来(天然) | 生物種:   Sulfolobus acidocaldarius (好気性・好酸性) Sulfolobus acidocaldarius (好気性・好酸性)株: MW001 |
| 配列 | 文字列: MNKLVGLLVS SLFLASILIG IAPAITTTAL TPPVSAGGIQ AYLLTGSGAP ASGLVLFVVN VSNIQVSSS NVTNVISTVV SNIQINAKTE NAQTGATTGS VTVRFPTSGY NAYYDSVDKV V FVVVSFLY PYTTTSVNIP LSYLSKYLPG LLTAQPYDET GAQVTSVSST ...文字列: MNKLVGLLVS SLFLASILIG IAPAITTTAL TPPVSAGGIQ AYLLTGSGAP ASGLVLFVVN VSNIQVSSS NVTNVISTVV SNIQINAKTE NAQTGATTGS VTVRFPTSGY NAYYDSVDKV V FVVVSFLY PYTTTSVNIP LSYLSKYLPG LLTAQPYDET GAQVTSVSST PFGSLIDTST GQ QILGTNP VLTSYNSYTT QANTNMQEGV VSGTLTSFTL GGQSFSGSTV PVILYAPFIF SNS PYQAGL YNPMQVNGNL GSLSSEAYYH PVIWGRALIN TTLIDTYASG SVPFTFQLNY SVPG PLTIN MAQLAWIASI NNLPTSFTYL SYKFSNGYES FLGIISNSTQ LTAGALTINP SGNFT INGK KFYVYLLVVG STNSTTPVEY VTKLVVEYPS STNFLPQGVT VTTSSNKYTL PVYEIG GPA GTTITLTGNW YSTPYTVQIT VGSTPTLTNY VSQILLKAVA YEGINVSTTQ SPYYSTA IL STPPSEISIT GSSTITAQGK LTATSASATV NLLTNATLTY ENIPLTQYSF NGIIVTPG Y AAINGTTAMA YVIGALYNKT SDYVLSFAGS QEPMQVMNNN LTEVTTLAPF GLTLLAPSV PATETGTSPL QLEFFTVPST SYIALVDFGL WGNLTSVTVS AYDTVNNKLS VNLGYFYGIV IPPSISTAP YNYQNFICPN NYVTVTIYDP DAVLDPYPSG SFTTSSLPLK YGNMNITGAV I FPGSSVYN PSGVFGYSNF NKGAAVTTFT YTAQSGPFSP VALTGNTNYL SQYADNNPTD NY YFIQTVN GMPVLMGGLS IVASPVSASL PSSTSSPGFM YLLPSAAQVP SPLPGMATPN YNL NIYITY KIDGATVGNN MINGLYVASQ NTLIYVVPNG SFVGSNIKLT YTTTDYAVLH YFYS TGQYK VFKTVSVPNV TANLYFPSST TPLYQLSVPL YLSEPYYGSP LPTYIGLGTN GTSLW NSPN YVLFGVSAVQ QYLGFIKSIS VTLSNGTTVV IPLTTSNMQT LFPQLVGQEL QACNGT FQF GISITGLEKL LNLNVQQLNN SILSVTYHDY VTGETLTATT KLVALSTLSL VAKGAGV VE FLLTAYPYTG NITFAPPWFI AENVVKQPFM TYSDLQFAKT NPSAILSLST VNITVVGL G GKASVYYNST SGQTVITNIY GQTVATLSGN VLPTLTELAA GNGTFTGSLQ FTIVPNNTV VQIPSSLTKT SFAVYTNGSL AIVLNGKAYS LGPAGLFLLP FVTYTGSAIG ANATAIITVS DGVGTSTTQ VPITAENFTP IRLAPFQVPA QVPLPNAPKL KYEYNGSIVI TPQQQVLKIY V TSILPYPQ EFQIQAFVYE ASQFNVHTGS PTAAPVYFSY SAVRAYPALG IGTSVPNLLV YV QLQGISN LPAGKYVIVL SAVPFAGGPV LSEYPAQLIF TNVTLTQ |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | サブトモグラム平均法 |
| 試料の集合状態 | 3D array |
- 試料調製
試料調製
| 緩衝液 | pH: 4 |
|---|---|
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 300 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法 #1
電子顕微鏡法 #1
| Microscopy ID | 1 |
|---|---|
| 顕微鏡 | TFS KRIOS |
| 撮影 | Image recording ID: 1 フィルム・検出器のモデル: TFS FALCON 4i (4k x 4k) デジタル化 - サイズ - 横: 5760 pixel / デジタル化 - サイズ - 縦: 4092 pixel / 平均電子線量: 2.02 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 6.0 µm / 最小 デフォーカス(公称値): 4.0 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 電子顕微鏡法 #1~
電子顕微鏡法 #1~
| Microscopy ID | 1 |
|---|---|
| 顕微鏡 | TFS TALOS |
| 撮影 | Image recording ID: 2 フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) デジタル化 - サイズ - 横: 4096 pixel / デジタル化 - サイズ - 縦: 4096 pixel / 平均電子線量: 2.02 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 6.0 µm / 最小 デフォーカス(公称値): 4.0 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
 ムービー
ムービー コントローラー
コントローラー












 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)