+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Vaccinia C16 N-terminal domains | |||||||||||||||||||||
 マップデータ マップデータ | Map of C16 N-terminal domains in the C16-Ku70/Ku80 complex | |||||||||||||||||||||
 試料 試料 |
| |||||||||||||||||||||
 キーワード キーワード | C16 vaccinia virus protein Ku70/Ku80 DNA binding inhibition / VIRAL PROTEIN | |||||||||||||||||||||
| 機能・相同性 | Poxvirus C4/C10 / Poxvirus C4/C10 protein / Protein C10 機能・相同性情報 機能・相同性情報 | |||||||||||||||||||||
| 生物種 |   Vaccinia virus Western Reserve (ウイルス) Vaccinia virus Western Reserve (ウイルス) | |||||||||||||||||||||
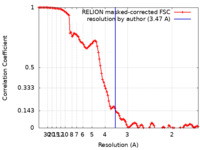
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.47 Å | |||||||||||||||||||||
 データ登録者 データ登録者 | Rivera-Calzada A / Arribas-Bosacoma R / Pearl LH / Llorca O | |||||||||||||||||||||
| 資金援助 |  スペイン, スペイン,  英国, 6件 英国, 6件
| |||||||||||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Structural basis for the inactivation of cytosolic DNA sensing by the vaccinia virus. 著者: Angel Rivera-Calzada / Raquel Arribas-Bosacoma / Alba Ruiz-Ramos / Paloma Escudero-Bravo / Jasminka Boskovic / Rafael Fernandez-Leiro / Antony W Oliver / Laurence H Pearl / Oscar Llorca /   要旨: Detection of cytosolic DNA is a central element of the innate immunity system against viral infection. The Ku heterodimer, a component of the NHEJ pathway of DNA repair in the nucleus, functions as ...Detection of cytosolic DNA is a central element of the innate immunity system against viral infection. The Ku heterodimer, a component of the NHEJ pathway of DNA repair in the nucleus, functions as DNA sensor that detects dsDNA of viruses that replicate in the cytoplasm. Vaccinia virus expresses two proteins, C4 and C16, that inactivate DNA sensing and enhance virulence. The structural basis for this is unknown. Here we determine the structure of the C16 - Ku complex using cryoEM. Ku binds dsDNA by a preformed ring but C16 sterically blocks this access route, abrogating binding to a dsDNA end and its insertion into DNA-PK, thereby averting signalling into the downstream innate immunity system. C4 replicates these activities using a domain with 54% identity to C16. Our results reveal how vaccinia virus subverts the capacity of Ku to recognize viral DNA. | |||||||||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_15414.map.gz emd_15414.map.gz | 90.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-15414-v30.xml emd-15414-v30.xml emd-15414.xml emd-15414.xml | 19.8 KB 19.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_15414_fsc.xml emd_15414_fsc.xml | 10.8 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_15414.png emd_15414.png | 67.8 KB | ||
| Filedesc metadata |  emd-15414.cif.gz emd-15414.cif.gz | 6.2 KB | ||
| その他 |  emd_15414_half_map_1.map.gz emd_15414_half_map_1.map.gz emd_15414_half_map_2.map.gz emd_15414_half_map_2.map.gz | 84.2 MB 84.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-15414 http://ftp.pdbj.org/pub/emdb/structures/EMD-15414 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15414 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-15414 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_15414_validation.pdf.gz emd_15414_validation.pdf.gz | 764.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_15414_full_validation.pdf.gz emd_15414_full_validation.pdf.gz | 763.9 KB | 表示 | |
| XML形式データ |  emd_15414_validation.xml.gz emd_15414_validation.xml.gz | 17.6 KB | 表示 | |
| CIF形式データ |  emd_15414_validation.cif.gz emd_15414_validation.cif.gz | 23.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15414 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15414 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15414 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-15414 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_15414.map.gz / 形式: CCP4 / 大きさ: 107.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_15414.map.gz / 形式: CCP4 / 大きさ: 107.2 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Map of C16 N-terminal domains in the C16-Ku70/Ku80 complex | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.835 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half map 1
| ファイル | emd_15414_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half map 2
| ファイル | emd_15414_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : C16 N-terminal domains in the C16-Ku70/Ku80 complex
| 全体 | 名称: C16 N-terminal domains in the C16-Ku70/Ku80 complex |
|---|---|
| 要素 |
|
-超分子 #1: C16 N-terminal domains in the C16-Ku70/Ku80 complex
| 超分子 | 名称: C16 N-terminal domains in the C16-Ku70/Ku80 complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 230 KDa |
-分子 #1: Protein C10
| 分子 | 名称: Protein C10 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Vaccinia virus Western Reserve (ウイルス) / 株: Western Reserve Vaccinia virus Western Reserve (ウイルス) / 株: Western Reserve |
| 分子量 | 理論値: 42.47668 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MDIYDDKGLQ TIKLFNNEFD CIRNDIRELF KHVTDSDSIQ LPMEDNSDII ENIRKILYRR LKNVECVDID STITFMKYDP NDDNKRTCS NWVPLTNNYM EYCLVIYLET PICGGKIKLY HPTGNIKSDK DIMFAKTLDF KSKKVLTGRK TIAVLDISVS Y NRSMTTIH ...文字列: MDIYDDKGLQ TIKLFNNEFD CIRNDIRELF KHVTDSDSIQ LPMEDNSDII ENIRKILYRR LKNVECVDID STITFMKYDP NDDNKRTCS NWVPLTNNYM EYCLVIYLET PICGGKIKLY HPTGNIKSDK DIMFAKTLDF KSKKVLTGRK TIAVLDISVS Y NRSMTTIH YNDDVDIDIH TDKNGKELCY CYITIDDHYL VDVETIGVIV NRSGKCLLVN NHLGIGIVKD KRISDSFGDV CM DTIFDFS EARELFSLTN DDNRNIAWDT DKLDDDTDIW TPVTEDDYKF LSRLVLYAKS QSDTVFDYYV LTGDTEPPTV FIF KVTRFY FNMPKGGENL YFQGWSHPQF EKGGGSGGGS GGSSAWSHPQ FEK UniProtKB: Protein C10 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.4 mg/mL | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.9 構成要素:
| ||||||||||||||||||
| グリッド | モデル: Quantifoil R0.6/1 / 材質: COPPER / メッシュ: 300 | ||||||||||||||||||
| 凍結 | 凍結剤: ETHANE-PROPANE / チャンバー内湿度: 100 % / チャンバー内温度: 278 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 実像数: 13216 / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 0.6 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 詳細 | Initial model for chains C and D was generated using AlphaFold2 |
|---|---|
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
| 得られたモデル |  PDB-8ag3: |
 ムービー
ムービー コントローラー
コントローラー








 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)