+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Tail assembly of the phicrAss001 virion with C6 symmetry imposed | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報virus tail / biological process involved in interaction with host / host cell membrane / viral life cycle / virion component / viral capsid / symbiont entry into host cell / membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Bacteroides phage crAss001 (ファージ) Bacteroides phage crAss001 (ファージ) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.33 Å | |||||||||
 データ登録者 データ登録者 | Bayfield OW / Shkoporov AN / Yutin N / Khokhlova EV / Smith JLR / Hawkins DEDP / Koonin EV / Hill C / Antson AA | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2023 ジャーナル: Nature / 年: 2023タイトル: Structural atlas of a human gut crassvirus. 著者: Oliver W Bayfield / Andrey N Shkoporov / Natalya Yutin / Ekaterina V Khokhlova / Jake L R Smith / Dorothy E D P Hawkins / Eugene V Koonin / Colin Hill / Alfred A Antson /    要旨: CrAssphage and related viruses of the order Crassvirales (hereafter referred to as crassviruses) were originally discovered by cross-assembly of metagenomic sequences. They are the most abundant ...CrAssphage and related viruses of the order Crassvirales (hereafter referred to as crassviruses) were originally discovered by cross-assembly of metagenomic sequences. They are the most abundant viruses in the human gut, are found in the majority of individual gut viromes, and account for up to 95% of the viral sequences in some individuals. Crassviruses are likely to have major roles in shaping the composition and functionality of the human microbiome, but the structures and roles of most of the virally encoded proteins are unknown, with only generic predictions resulting from bioinformatic analyses. Here we present a cryo-electron microscopy reconstruction of Bacteroides intestinalis virus ΦcrAss001, providing the structural basis for the functional assignment of most of its virion proteins. The muzzle protein forms an assembly about 1 MDa in size at the end of the tail and exhibits a previously unknown fold that we designate the 'crass fold', that is likely to serve as a gatekeeper that controls the ejection of cargos. In addition to packing the approximately 103 kb of virus DNA, the ΦcrAss001 virion has extensive storage space for virally encoded cargo proteins in the capsid and, unusually, within the tail. One of the cargo proteins is present in both the capsid and the tail, suggesting a general mechanism for protein ejection, which involves partial unfolding of proteins during their extrusion through the tail. These findings provide a structural basis for understanding the mechanisms of assembly and infection of these highly abundant crassviruses. #1:  ジャーナル: Res Sq / 年: 2023 ジャーナル: Res Sq / 年: 2023タイトル: Structural atlas of the most abundant human gut virus 著者: Antson A / Bayfield O / Shkoporov A / Yutin N / Khokhlova E / Smith J / Hawkins D / Koonin E / Hill C | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_14094.map.gz emd_14094.map.gz | 530 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-14094-v30.xml emd-14094-v30.xml emd-14094.xml emd-14094.xml | 28.3 KB 28.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_14094_fsc.xml emd_14094_fsc.xml | 22.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_14094.png emd_14094.png | 61.6 KB | ||
| その他 |  emd_14094_additional_1.map.gz emd_14094_additional_1.map.gz emd_14094_additional_2.map.gz emd_14094_additional_2.map.gz | 53.2 MB 911.4 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-14094 http://ftp.pdbj.org/pub/emdb/structures/EMD-14094 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14094 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-14094 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_14094_validation.pdf.gz emd_14094_validation.pdf.gz | 488.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_14094_full_validation.pdf.gz emd_14094_full_validation.pdf.gz | 488.5 KB | 表示 | |
| XML形式データ |  emd_14094_validation.xml.gz emd_14094_validation.xml.gz | 18.9 KB | 表示 | |
| CIF形式データ |  emd_14094_validation.cif.gz emd_14094_validation.cif.gz | 26.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14094 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14094 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14094 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-14094 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7qolMC  7qofC  7qogC  7qohC  7qoiC  7qojC  7qokC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_14094.map.gz / 形式: CCP4 / 大きさ: 1000 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_14094.map.gz / 形式: CCP4 / 大きさ: 1000 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.3941 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: #1
| ファイル | emd_14094_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
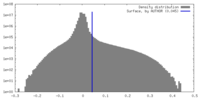
| 密度ヒストグラム |
-追加マップ: #2
| ファイル | emd_14094_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
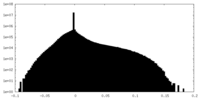
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
+全体 : Bacteroides phage crAss001
+超分子 #1: Bacteroides phage crAss001
+分子 #1: Portal protein gp20
+分子 #2: Ring protein 1 gp43
+分子 #3: Ring protein 2 gp40
+分子 #4: Ring protein 3 gp35
+分子 #5: Ring protein 4/5 gp34
+分子 #6: Tail hub protein A gp38
+分子 #7: Tail hub protein B gp39
+分子 #8: Tail fiber protein gp22
+分子 #9: Cargo protein 1 gp45
+分子 #10: Muzzle protein gp44
+分子 #11: Muzzle bound helix
+分子 #12: MAGNESIUM ION
+分子 #13: water
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: INTEGRATING / 平均電子線量: 51.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 1.5 µm / 最小 デフォーカス(公称値): 0.3 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: AB INITIO MODEL / 温度因子: 129 |
|---|---|
| 得られたモデル |  PDB-7qol: |
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)