+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of the Smc5/6-holocomplex (composite structure) | |||||||||
 マップデータ マップデータ | CryoEM structure of the Smc5/6 holocomplex; composite map | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Structural Maintenance of Chromosomes / SMC / holo-complex / recombination / stalled replication fork | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Smc5-Smc6 complex / resolution of DNA recombination intermediates / DNA double-strand break attachment to nuclear envelope / SUMO ligase activity / chromosome separation / Platelet degranulation / SUMOylation of DNA damage response and repair proteins / chromatin looping / 転移酵素; アシル基を移すもの; アミノアシル基を移すもの / SUMO transferase activity ...Smc5-Smc6 complex / resolution of DNA recombination intermediates / DNA double-strand break attachment to nuclear envelope / SUMO ligase activity / chromosome separation / Platelet degranulation / SUMOylation of DNA damage response and repair proteins / chromatin looping / 転移酵素; アシル基を移すもの; アミノアシル基を移すもの / SUMO transferase activity / postreplication repair / regulation of telomere maintenance / recombinational repair / protein sumoylation / protein serine/threonine kinase inhibitor activity / double-strand break repair via homologous recombination / RING-type E3 ubiquitin transferase / ubiquitin-protein transferase activity / nuclear envelope / single-stranded DNA binding / site of double-strand break / damaged DNA binding / chromosome, telomeric region / DNA repair / ATP hydrolysis activity / mitochondrion / zinc ion binding / ATP binding / nucleus / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |   | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 8.0 Å | |||||||||
 データ登録者 データ登録者 | Hallett ST / Oliver AW | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nucleic Acids Res / 年: 2022 ジャーナル: Nucleic Acids Res / 年: 2022タイトル: Cryo-EM structure of the Smc5/6 holo-complex. 著者: Stephen T Hallett / Isabella Campbell Harry / Pascale Schellenberger / Lihong Zhou / Nora B Cronin / Jonathan Baxter / Thomas J Etheridge / Johanne M Murray / Antony W Oliver /  要旨: The Smc5/6 complex plays an essential role in the resolution of recombination intermediates formed during mitosis or meiosis, or as a result of the cellular response to replication stress. It also ...The Smc5/6 complex plays an essential role in the resolution of recombination intermediates formed during mitosis or meiosis, or as a result of the cellular response to replication stress. It also functions as a restriction factor preventing viral replication. Here, we report the cryogenic EM (cryo-EM) structure of the six-subunit budding yeast Smc5/6 holo-complex, reconstituted from recombinant proteins expressed in insect cells - providing both an architectural overview of the entire complex and an understanding of how the Nse1/3/4 subcomplex binds to the hetero-dimeric SMC protein core. In addition, we demonstrate that a region within the head domain of Smc5, equivalent to the 'W-loop' of Smc4 or 'F-loop' of Smc1, mediates an important interaction with Nse1. Notably, mutations that alter the surface-charge profile of the region of Nse1 which accepts the Smc5-loop, lead to a slow-growth phenotype and a global reduction in the chromatin-associated fraction of the Smc5/6 complex, as judged by single molecule localisation microscopy experiments in live yeast. Moreover, when taken together, our data indicates functional equivalence between the structurally unrelated KITE and HAWK accessory subunits associated with SMC complexes. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_13895.map.gz emd_13895.map.gz | 106.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-13895-v30.xml emd-13895-v30.xml emd-13895.xml emd-13895.xml | 22.9 KB 22.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_13895.png emd_13895.png | 30 KB | ||
| Filedesc metadata |  emd-13895.cif.gz emd-13895.cif.gz | 8.6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-13895 http://ftp.pdbj.org/pub/emdb/structures/EMD-13895 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13895 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-13895 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_13895_validation.pdf.gz emd_13895_validation.pdf.gz | 393.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_13895_full_validation.pdf.gz emd_13895_full_validation.pdf.gz | 392.8 KB | 表示 | |
| XML形式データ |  emd_13895_validation.xml.gz emd_13895_validation.xml.gz | 6.7 KB | 表示 | |
| CIF形式データ |  emd_13895_validation.cif.gz emd_13895_validation.cif.gz | 7.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13895 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13895 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13895 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-13895 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7qcdMC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_13895.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_13895.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM structure of the Smc5/6 holocomplex; composite map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 2.2 Å | ||||||||||||||||||||||||||||||||||||
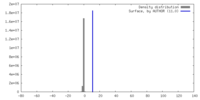
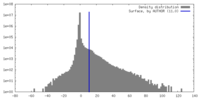
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Smc5/6 holo-complex
| 全体 | 名称: Smc5/6 holo-complex |
|---|---|
| 要素 |
|
-超分子 #1: Smc5/6 holo-complex
| 超分子 | 名称: Smc5/6 holo-complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#6 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Structural maintenance of chromosomes protein 5
| 分子 | 名称: Structural maintenance of chromosomes protein 5 / タイプ: protein_or_peptide / ID: 1 詳細: Saccharomyces cerevisiase Smc5 fused to C-terminal FLAG-tag. コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 126.23618 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MTSLIDLGRY VERTHHGEDT EPRSKRVKIA KPDLSSFQPG SIIKIRLQDF VTYTLTEFNL SPSLNMIIGP NGSGKSTFVC AVCLGLAGK PEYIGRSKKV EDFIKNGQDV SKIEITLKNS PNVTDIEYID ARDETIKITR IITRSKRRSD YLINDYQVSE S VVKTLVAQ ...文字列: MTSLIDLGRY VERTHHGEDT EPRSKRVKIA KPDLSSFQPG SIIKIRLQDF VTYTLTEFNL SPSLNMIIGP NGSGKSTFVC AVCLGLAGK PEYIGRSKKV EDFIKNGQDV SKIEITLKNS PNVTDIEYID ARDETIKITR IITRSKRRSD YLINDYQVSE S VVKTLVAQ LNIQLDNLCQ FLSQERVEEF ARLKSVKLLV ETIRSIDASL LDVLDELREL QGNEQSLQKD LDFKKAKIVH LR QESDKLR KSVESLRDFQ NKKGEIELHS QLLPYVKVKD HKEKLNIYKE EYERAKANLR AILKDKKPFA NTKKTLENQV EEL TEKCSL KTDEFLKAKE KINEIFEKLN TIRDEVIKKK NQNEYYRGRT KKLQATIIST KEDFLRSQEI LAQTHLPEKS VFED IDIKR KEIINKEGEI RDLISEIDAK ANAINHEMRS IQRQAESKTK SLTTTDKIGI LNQDQDLKEV RDAVLMVREH PEMKD KILE PPIMTVSAIN AQFAAYLAQC VDYNTSKALT VVDSDSYKLF ANPILDKFKV NLRELSSADT TPPVPAETVR DLGFEG YLS DFITGDKRVM KMLCQTSKIH TIPVSRRELT PAQIKKLITP RPNGKILFKR IIHGNRLVDI KQSAYGSKQV FPTDVSI KQ TNFYQGSIMS NEQKIRIENE IINLKNEYND RKSTLDALSN QKSGYRHELS ELASKNDDIN REAHQLNEIR KKYTMRKS T IETLREKLDQ LKREARKDVS QKIKDIDDQI QQLLLKQRHL LSKMASSMKS LKNCQKELIS TQILQFEAQN MDVSMNDVI GFFNEREADL KSQYEDKKKF VKEMRDTPEF QSWMREIRSY DQDTKEKLNK VAEKYEEEGN FNLSFVQDVL DKLESEIAMV NHDESAVTI LDQVTAELRE LEHTVPQQSK DLETIKAKLK EDHAVLEPKL DDIVSKISAR FARLFNNVGS AGAVRLEKPK D YAEWKIEI MVKFRDNAPL KKLDSHTQSG GERAVSTVLY MIALQEFTSA PFRVVDQINQ GMDSRNERIV HKAMVENACA EN TSQYFLI TPKLLTGLHY HEKMRIHCVM AGSWIPNPSE DPKMIHFGET SNYSFD UniProtKB: Structural maintenance of chromosomes protein 5 |
-分子 #2: Structural maintenance of chromosomes protein 6
| 分子 | 名称: Structural maintenance of chromosomes protein 6 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 128.198742 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MISTTISGKR PIEQVDDELL SLTAQQENEE QQQQRKRRRH QFAPMTQFNS NTLDEDSGFR SSSDVATADQ DNFLEESPSG YIKKVILRN FMCHEHFELE LGSRLNFIVG NNGSGKSAIL TAITIGLGAK ASETNRGSSL KDLIREGCYS AKIILHLDNS K YGAYQQGI ...文字列: MISTTISGKR PIEQVDDELL SLTAQQENEE QQQQRKRRRH QFAPMTQFNS NTLDEDSGFR SSSDVATADQ DNFLEESPSG YIKKVILRN FMCHEHFELE LGSRLNFIVG NNGSGKSAIL TAITIGLGAK ASETNRGSSL KDLIREGCYS AKIILHLDNS K YGAYQQGI FGNEIIVERI IKRDGPASFS LRSENGKEIS NKKKDIQTVV DYFSVPVSNP MCFLSQDAAR SFLTASTSQD KY SHFMKGT LLQEITENLL YASAIHDSAQ ENMALHLENL KSLKAEYEDA KKLLRELNQT SDLNERKMLL QAKSLWIDVA HNT DACKNL ENEISGIQQK VDEVTEKIRN RQEKIERYTS DGTTIEAQID AKVIYVNEKD SEHQNARELL RDVKSRFEKE KSNQ AEAQS NIDQGRKKVD ALNKTIAHLE EELTKEMGGD KDQMRQELEQ LEKANEKLRE VNNSLVVSLQ DVKNEERDIQ HERES ELRT ISRSIQNKKV ELQNIAKGND TFLMNFDRNM DRLLRTIEQR KNEFETPAIG PLGSLVTIRK GFEKWTRSIQ RAISSS LNA FVVSNPKDNR LFRDIMRSCG IRSNIPIVTY CLSQFDYSKG RAHGNYPTIV DALEFSKPEI ECLFVDLSRI ERIVLIE DK NEARNFLQRN PVNVNMALSL RDRRSGFQLS GGYRLDTVTY QDKIRLKVNS SSDNGTQYLK DLIEQETKEL QNIRDRYE E KLSEVRSRLK EIDGRLKSTK NEMRKTNFRM TELKMNVGKV VDTGILNSKI NERKNQEQAI ASYEAAKEEL GLKIEQIAQ EAQPIKEQYD STKLALVEAQ DELQQLKEDI NSRQSKIQKY KDDTIYYEDK KKVYLENIKK IEVNVAALKE GIQRQIQNAC AFCSKERIE NVDLPDTQEE IKRELDKVSR MIQKAEKSLG LSQEEVIALF EKCRNKYKEG QKKYMEIDEA LNRLHNSLKA R DQNYKNAE KGTCFDADMD FRASLKVRKF SGNLSFIKDT KSLEIYILTT NDEKARNVDT LSGGEKSFSQ MALLLATWKP MR SRIIALD QFDVFMDQVN RKIGTTLIVK KLKDIARTQT IIITPQDIGK IADIDSSGVS IHRMRDPERQ NNSNFYN UniProtKB: Structural maintenance of chromosomes protein 6 |
-分子 #3: E3 SUMO-protein ligase MMS21
| 分子 | 名称: E3 SUMO-protein ligase MMS21 / タイプ: protein_or_peptide / ID: 3 詳細: Saccharomyces cerevisiae Nse2 fused to N-terminal HA-tag. コピー数: 1 / 光学異性体: LEVO EC番号: 転移酵素; アシル基を移すもの; アミノアシル基を移すもの |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 31.817775 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MGSYPYDVPD YAGSGALNDN PIPKSVPLHP KSGKYFHNLH ARDLSNIYQQ CYKQIDETIN QLVDSTSPST IGIEEQVADI TSTYKLLST YESESNSFDE HIKDLKKNFK QSSDACPQID LSTWDKYRTG ELTAPKLSEL YLNMPTPEPA TMVNNTDTLK I LKVLPYIW ...文字列: MGSYPYDVPD YAGSGALNDN PIPKSVPLHP KSGKYFHNLH ARDLSNIYQQ CYKQIDETIN QLVDSTSPST IGIEEQVADI TSTYKLLST YESESNSFDE HIKDLKKNFK QSSDACPQID LSTWDKYRTG ELTAPKLSEL YLNMPTPEPA TMVNNTDTLK I LKVLPYIW NDPTCVIPDL QNPADEDDLQ IEGGKIELTC PITCKPYEAP LISRKCNHVF DRDGIQNYLQ GYTTRDCPQA AC SQVVSMR DFVRDPIMEL RCKIAKMKES QEQDKRSSQA IDVL UniProtKB: E3 SUMO-protein ligase MMS21 |
-分子 #4: Non-structural maintenance of chromosomes element 1
| 分子 | 名称: Non-structural maintenance of chromosomes element 1 / タイプ: protein_or_peptide / ID: 4 詳細: Saccharomyces cerevisiae Nse1 fused to N-terminal TEV-cleavable His6-tag. コピー数: 1 / 光学異性体: LEVO / EC番号: RING-type E3 ubiquitin transferase |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 40.943113 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MGSSHHHHHH SSGRENLYFQ GHMEVHEEQV SAPVTGDATA KYLLQYILSA RGICHENALI LALMRLETDA STLNTEWSIQ QWVDKLNDY INAINVKLNL LGYKIIRINH GIGRNAVTLK AKQNFESFED NTAIRAHNND YAVLQSIVLP ESNRFFVYVN L ASTEETKL ...文字列: MGSSHHHHHH SSGRENLYFQ GHMEVHEEQV SAPVTGDATA KYLLQYILSA RGICHENALI LALMRLETDA STLNTEWSIQ QWVDKLNDY INAINVKLNL LGYKIIRINH GIGRNAVTLK AKQNFESFED NTAIRAHNND YAVLQSIVLP ESNRFFVYVN L ASTEETKL ATRFNQNEIE FMKWAIEQFM ISGETIVEGP ALETSIIVKE VNRILVAATG DSNLAKWRKF STFTVGSTNL FQ FQELTAT DIEDLLLRLC ELKWFYRTQE GKFGIDLRCI AELEEYLTSM YNLNTCQNCH KLAIQGVRCG NESCREENEE TGE NSLSQI WHVDCFKHYI THVSKNCDRC GSSLITEGVY VI UniProtKB: Non-structural maintenance of chromosomes element 1 |
-分子 #5: Non-structural maintenance of chromosome element 3
| 分子 | 名称: Non-structural maintenance of chromosome element 3 / タイプ: protein_or_peptide / ID: 5 / 詳細: Saccharomyces cerevisiae Nse3, untagged. / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 34.005531 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSSIDNDSDV DLTEDLAVAK IVKENPVARK MVRYILSRGE SQNSIITRNK LQSVIHEAAR EENIAKPSFS KMFMDINAIL YNVYGFELQ GLPSKNNMNA GGNGSNSNTN KSMPEPLGHR AQKFILLNNV PHSKNFDDFK ILQSAHTYEE LIVTGEYIGD D IASGTSNT ...文字列: MSSIDNDSDV DLTEDLAVAK IVKENPVARK MVRYILSRGE SQNSIITRNK LQSVIHEAAR EENIAKPSFS KMFMDINAIL YNVYGFELQ GLPSKNNMNA GGNGSNSNTN KSMPEPLGHR AQKFILLNNV PHSKNFDDFK ILQSAHTYEE LIVTGEYIGD D IASGTSNT LESKLSTDRD LVYKGVLSVI LCIVFFSKNN ILHQELIKFL ETFGIPSDGS KIAILNITIE DLIKSLEKRE YI VRLEEKS DTDGEVISYR IGRRTQAELG LESLEKLVQE IMGLEKEQTK SLHDDIIKSI GDSYSI UniProtKB: Non-structural maintenance of chromosome element 3 |
-分子 #6: Non-structural maintenance of chromosome element 4
| 分子 | 名称: Non-structural maintenance of chromosome element 4 / タイプ: protein_or_peptide / ID: 6 詳細: Saccharomyces cerevisiae Nse4 fused to a C-terminal HALO-myc tag. コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  株: ATCC 204508 / S288c |
| 分子量 | 理論値: 81.441133 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSSTVISRKR RNSTVTEPDS SGETRKQKKS RSDEKSSSSK DGDPQLEFKV LQGYRDLESE MHKGRAQVTR TGDIGVAMDN LNAVDSLFN KVIGIKNNGL FAHDARAMVS ISELAQISVR NLKFDDSRSM VNLENIVNSL KRYMLKEHFK LNNIAENRND L TLAADEQS ...文字列: MSSTVISRKR RNSTVTEPDS SGETRKQKKS RSDEKSSSSK DGDPQLEFKV LQGYRDLESE MHKGRAQVTR TGDIGVAMDN LNAVDSLFN KVIGIKNNGL FAHDARAMVS ISELAQISVR NLKFDDSRSM VNLENIVNSL KRYMLKEHFK LNNIAENRND L TLAADEQS AADQQEESDG DIDRTPDDNH TDKATSSFKA TSMRHSYLQQ FSHYNEFSQF NWFRIGALYN TISKNAPITD HL MGPLSIE KKPRVLTQRR RNNDQVGEKI TAEKITQHSL NSTQQETTPE QVKKCFKKLS KKLGPEGSIN LFKFIIDPNS FSR SIENLF YTSFLIKEGK LLMEHDEEGL PTIKIKQSIS HTDSRSKEIE RQRRRAAHQN HIIFQMDMPT WRKLIKKYNI TSPF LDGSS GMAEIGTGFP FDPHYVEVLG ERMHYVDVGP RDGTPVLFLH GNPTSSYVWR NIIPHVAPTH RCIAPDLIGM GKSDK PDLG YFFDDHVRFM DAFIEALGLE EVVLVIHDWG SALGFHWAKR NPERVKGIAF MEFIRPIPTW DEWPEFARET FQAFRT TDV GRKLIIDQNV FIEGTLPMGV VRPLTEVEMD HYREPFLNPV DREPLWRFPN ELPIAGEPAN IVALVEEYMD WLHQSPV PK LLFWGTPGVL IPPAEAARLA KSLPNCKAVD IGPGLNLLQE DNPDLIGSEI ARWLSTLEIS GGSEQKLISE EDL UniProtKB: Non-structural maintenance of chromosome element 4 |
-分子 #7: ZINC ION
| 分子 | 名称: ZINC ION / タイプ: ligand / ID: 7 / コピー数: 3 / 式: ZN |
|---|---|
| 分子量 | 理論値: 65.409 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.1 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| ||||||||||||
| グリッド | モデル: Quantifoil R0.6/1 / 材質: COPPER / メッシュ: 300 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. 詳細: Glow-discharged for a period of 60 seconds at 15mA, PELCO easiGlow, Leica Microsystems, Germany. | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 293 K / 装置: LEICA EM GP 詳細: Held in chamber for a period of 10 seconds, before blotting for 2.5 to 4.5 seconds (auto-sensor) then plunged into liquid ethane before being stored under liquid nitrogen.. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 4 / 平均電子線量: 1.3 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 8.0 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: cryoSPARC (ver. 3.1.0) / 使用した粒子像数: 1 |
| 初期 角度割当 | タイプ: ANGULAR RECONSTITUTION / ソフトウェア - 名称: cryoSPARC (ver. 3.1.0) |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD / ソフトウェア - 名称: cryoSPARC (ver. 3.1.0) |
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: OTHER |
|---|---|
| 得られたモデル |  PDB-7qcd: |
 ムービー
ムービー コントローラー
コントローラー







 X (Sec.)
X (Sec.) Y (Row.)
Y (Row.) Z (Col.)
Z (Col.)