+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-7794 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Thermostabilized phosphorylated chicken CFTR | |||||||||
 マップデータ マップデータ | Binned Sharp map PKA-treated chTS | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | CFTR / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報RHO GTPases regulate CFTR trafficking / RHOQ GTPase cycle / ABC-family proteins mediated transport / Cargo recognition for clathrin-mediated endocytosis / Aggrephagy / Clathrin-mediated endocytosis / Ub-specific processing proteases / channel-conductance-controlling ATPase / intracellularly ATP-gated chloride channel activity / bicarbonate transport ...RHO GTPases regulate CFTR trafficking / RHOQ GTPase cycle / ABC-family proteins mediated transport / Cargo recognition for clathrin-mediated endocytosis / Aggrephagy / Clathrin-mediated endocytosis / Ub-specific processing proteases / channel-conductance-controlling ATPase / intracellularly ATP-gated chloride channel activity / bicarbonate transport / bicarbonate transmembrane transporter activity / chloride channel complex / ATPase-coupled transmembrane transporter activity / ABC-type transporter activity / chloride transmembrane transport / isomerase activity / transmembrane transport / recycling endosome membrane / early endosome membrane / apical plasma membrane / endoplasmic reticulum membrane / ATP hydrolysis activity / ATP binding / membrane / plasma membrane / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
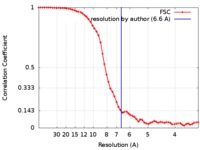
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 6.6 Å | |||||||||
 データ登録者 データ登録者 | Fay JF / Riordan JR | |||||||||
 引用 引用 |  ジャーナル: Biochemistry / 年: 2018 ジャーナル: Biochemistry / 年: 2018タイトル: Cryo-EM Visualization of an Active High Open Probability CFTR Anion Channel. 著者: Jonathan F Fay / Luba A Aleksandrov / Timothy J Jensen / Liying L Cui / Joseph N Kousouros / Lihua He / Andrei A Aleksandrov / Drew S Gingerich / John R Riordan / James Z Chen /  要旨: The cystic fibrosis transmembrane conductance regulator (CFTR) anion channel, crucial to epithelial salt and water homeostasis, and defective due to mutations in its gene in patients with cystic ...The cystic fibrosis transmembrane conductance regulator (CFTR) anion channel, crucial to epithelial salt and water homeostasis, and defective due to mutations in its gene in patients with cystic fibrosis, is a unique member of the large family of ATP-binding cassette transport proteins. Regulation of CFTR channel activity is stringently controlled by phosphorylation and nucleotide binding. Structural changes that underlie transitions between active and inactive functional states are not yet fully understood. Indeed the first 3D structures of dephosphorylated, ATP-free, and phosphorylated ATP-bound states were only recently reported. Here we have determined the structure of inactive and active states of a thermally stabilized CFTR, the latter with a very high channel open probability, confirmed after reconstitution into proteoliposomes. These structures, obtained at nominal resolution of 4.3 and 6.6 Å, reveal a unique repositioning of the transmembrane helices and regulatory domain density that provide insights into the structural transition between active and inactive functional states of CFTR. Moreover, we observe an extracellular vestibule that may provide anion access to the pore due to the conformation of transmembrane helices 7 and 8 that differs from the previous orthologue CFTR structures. In conclusion, our work contributes detailed structural information on an active, open state of the CFTR anion channel. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_7794.map.gz emd_7794.map.gz | 14.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-7794-v30.xml emd-7794-v30.xml emd-7794.xml emd-7794.xml | 17.8 KB 17.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_7794_fsc.xml emd_7794_fsc.xml | 6.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_7794.png emd_7794.png | 80 KB | ||
| Filedesc metadata |  emd-7794.cif.gz emd-7794.cif.gz | 6.3 KB | ||
| その他 |  emd_7794_half_map_1.map.gz emd_7794_half_map_1.map.gz emd_7794_half_map_2.map.gz emd_7794_half_map_2.map.gz | 14.5 MB 14.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-7794 http://ftp.pdbj.org/pub/emdb/structures/EMD-7794 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-7794 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-7794 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_7794_validation.pdf.gz emd_7794_validation.pdf.gz | 891.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_7794_full_validation.pdf.gz emd_7794_full_validation.pdf.gz | 891.1 KB | 表示 | |
| XML形式データ |  emd_7794_validation.xml.gz emd_7794_validation.xml.gz | 11.4 KB | 表示 | |
| CIF形式データ |  emd_7794_validation.cif.gz emd_7794_validation.cif.gz | 15.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-7794 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-7794 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-7794 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-7794 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6d3sMC  7793C  6d3rC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10219 (タイトル: Cryo-electron microscopy data of thermostabilized avian CFTR EMPIAR-10219 (タイトル: Cryo-electron microscopy data of thermostabilized avian CFTRData size: 19.3 Data #1: Binned Particle stacks and meta data for cryo-EM structures of phosphorylated and dephosphorylated avian CFTR [picked particles - multiframe - processed]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_7794.map.gz / 形式: CCP4 / 大きさ: 15.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_7794.map.gz / 形式: CCP4 / 大きさ: 15.6 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Binned Sharp map PKA-treated chTS | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.71 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
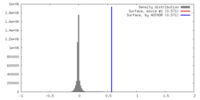
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-ハーフマップ: half map
| ファイル | emd_7794_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
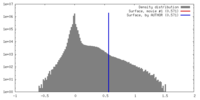
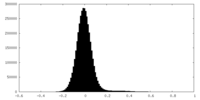
| 密度ヒストグラム |
-ハーフマップ: other half map
| ファイル | emd_7794_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | other half map | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
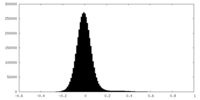
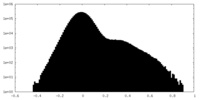
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : CFTR
| 全体 | 名称: CFTR |
|---|---|
| 要素 |
|
-超分子 #1: CFTR
| 超分子 | 名称: CFTR / タイプ: cell / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: Cystic fibrosis transmembrane conductance regulator
| 分子 | 名称: Cystic fibrosis transmembrane conductance regulator / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO / EC番号: ec: 3.6.3.49 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 162.637438 KDa |
| 組換発現 | 生物種:  Cricetinae (ネズミ) Cricetinae (ネズミ) |
| 配列 | 文字列: MQRSPLEKAN IFSKLFFRWT KPILKKGYRQ RLELSDIYQI PSADSADNLS EKLEREWDRE LATSKKKPKL INALRRCFFW KFMFYGILL YLGEVTKSVQ PLLLGRIIAS YDPDNSSERS IAYYLGIGLC LLFLVRTLLI HPSIFGLHHI GMQIRIALFS L IYKKTLKL ...文字列: MQRSPLEKAN IFSKLFFRWT KPILKKGYRQ RLELSDIYQI PSADSADNLS EKLEREWDRE LATSKKKPKL INALRRCFFW KFMFYGILL YLGEVTKSVQ PLLLGRIIAS YDPDNSSERS IAYYLGIGLC LLFLVRTLLI HPSIFGLHHI GMQIRIALFS L IYKKTLKL SSKVLDKIST GQLVSLLSNN LNKFDEGLAL AHFVWIAPLQ VALLMGLLWD MLQASAFAGL AFLIVMAFFQ AW LGQMMMK YRDKRAGKIN ERLVITSEII ENIQSVKAYC WEDAMEKMIE SLRETELKLT RKAAYVRYFN SSAFFFSGFF VVF LAVVPY AVTKGIILRK IFTTISFCIV LRMTVTRQFP GSVQTWYDSI GAINKIQDFL LKEEYKALEY NLTTTGVEVD KVTA FWDEH ASPVLQDINF KIEKGELLAV SGSTGSGKTS LLMLIMGELE PSEGKIKHSG RISFSPQVSW IMPGTIKENI IFGVS YDEY RYKSVIQACQ LEEDILKFPD KDYTVLGEGG IILSGGQRAR ISLARAVYKD ADLYLMDSPF GYLDIFTEKE IFESCV CKL MANKTRILVT SKLEHLKIAD KILILHEGSC YFYGTFSELQ GQRPDFSSEL MGFDSFDQFS AERRNSIITE TLRRFSF EG ESMGSRNEMK KQSFKQTSDF NDKRKNSIII NPLNAGRKLS IMQKNGTQVN GLEDGHIDSP ERRISLVPDL EQGDVGLP R SNMLNSDHML QSRRRQSVLS LMTGTSVNQG PHVSKKGSTS FRKMSVVPQT NLSSEIDIYT RRLSRDSILD ITDEINEED LKECFTDDAE SMGTVTTWNT YFRYITIHKS LIFVLILCVT IFLLEVAASL VLLLFLQKAA QINATQPENA TSDNPPVIIT DTSSYYMIY IYVGIADTLL AMGIFRGLPL VHTLITVSKT LHQKMVHAVL YAPMSTFNSL KAGGILNRFS KDTAILDDLL P LTVFDLIQ LILIVIGAIT VVSILQPYIF LASVPVIAAF IVLRAYFLHT SQQLKQLESE ARSPIFTHLV TSLKGLWTLR AF GRQPYFE TLFHKALNLH TANWFLYLST LRWFQMRIEM IFVVFFSAVA FISIITTGDG PGRVGIILTL AMNIMGTLQW AVN SSIDVD SLMRSVSRIF KFIDMPTEEM KTIKPQKNNQ FSDALIIENR HVKDEKNWPS GGQMTVTDLT ARYTEGGTAV LENI SFSIS SGQTVGLLGR TGSGKSTLLF AFLRLLNTEG DIQIDGVSWN TVSLQQWRKA FGVIPQKVFI FSGTFRKNLD PYGQW NDEE IWKVAEEVGL KSVIEQFPGQ LDFVLVDGGC VLSHGHKQLM CLARSVLSKA KILLLDEPSA HLDPITSQVI RKTLKH AFA DCTVVLSESR LEAILECQRF LVIEDNKMRQ YESIQKLLSE KSSLRQSGSG GGGGGSLEVL FQGDHHHHHH HHHH UniProtKB: Cystic fibrosis transmembrane conductance regulator |
-分子 #2: ADENOSINE-5'-TRIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-TRIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 2 / 式: ATP |
|---|---|
| 分子量 | 理論値: 507.181 Da |
| Chemical component information |  ChemComp-ATP: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | cell |
- 試料調製
試料調製
| 濃度 | 3.5 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.4 構成要素:
| ||||||||||||
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 400 / 前処理 - タイプ: GLOW DISCHARGE | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: SUPER-RESOLUTION / 撮影したグリッド数: 2 / 実像数: 3410 / 平均電子線量: 42.0 e/Å2 詳細: I had better girds but the vacuum crashed for the grids in the autoloader. |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: OTHER / 当てはまり具合の基準: iFSC, elec_dens_fast |
|---|---|
| 得られたモデル |  PDB-6d3s: |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)