+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
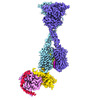
| タイトル | Structure of human calcium-sensing receptor in complex with chimeric Gq (miniGisq) protein in nanodiscs | |||||||||
 マップデータ マップデータ | Human CaSR-miniGis complex in nanodiscs, composite map of locally refined CaSR ECD, CaSR TMD and G protein | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Calcium-sensing receptor / G-protein-coupled receptor / G protein / signal transduction / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報bile acid secretion / chemosensory behavior / response to fibroblast growth factor / cellular response to peptide / cellular response to vitamin D / phosphatidylinositol phospholipase C activity / Class C/3 (Metabotropic glutamate/pheromone receptors) / calcium ion import / positive regulation of positive chemotaxis / fat pad development ...bile acid secretion / chemosensory behavior / response to fibroblast growth factor / cellular response to peptide / cellular response to vitamin D / phosphatidylinositol phospholipase C activity / Class C/3 (Metabotropic glutamate/pheromone receptors) / calcium ion import / positive regulation of positive chemotaxis / fat pad development / cellular response to hepatocyte growth factor stimulus / amino acid binding / branching morphogenesis of an epithelial tube / positive regulation of calcium ion import / regulation of calcium ion transport / cellular response to low-density lipoprotein particle stimulus / detection of calcium ion / anatomical structure morphogenesis / T cell migration / D2 dopamine receptor binding / Adenylate cyclase inhibitory pathway / positive regulation of protein localization to cell cortex / regulation of cAMP-mediated signaling / G protein-coupled serotonin receptor binding / cellular response to forskolin / axon terminus / positive regulation of vasoconstriction / JNK cascade / regulation of mitotic spindle organization / chloride transmembrane transport / adenylate cyclase-inhibiting G protein-coupled receptor signaling pathway / ossification / response to ischemia / Regulation of insulin secretion / G protein-coupled receptor binding / G protein-coupled receptor activity / cellular response to glucose stimulus / G-protein beta/gamma-subunit complex binding / positive regulation of insulin secretion / Olfactory Signaling Pathway / adenylate cyclase-modulating G protein-coupled receptor signaling pathway / Activation of the phototransduction cascade / G beta:gamma signalling through PLC beta / Presynaptic function of Kainate receptors / Thromboxane signalling through TP receptor / G protein-coupled acetylcholine receptor signaling pathway / G-protein activation / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / Prostacyclin signalling through prostacyclin receptor / response to peptide hormone / Glucagon signaling in metabolic regulation / G beta:gamma signalling through CDC42 / G beta:gamma signalling through BTK / ADP signalling through P2Y purinoceptor 12 / Sensory perception of sweet, bitter, and umami (glutamate) taste / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / photoreceptor disc membrane / Glucagon-type ligand receptors / Adrenaline,noradrenaline inhibits insulin secretion / Vasopressin regulates renal water homeostasis via Aquaporins / intracellular calcium ion homeostasis / G alpha (z) signalling events / vasodilation / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / cellular response to catecholamine stimulus / ADORA2B mediated anti-inflammatory cytokines production / sensory perception of taste / ADP signalling through P2Y purinoceptor 1 / G beta:gamma signalling through PI3Kgamma / adenylate cyclase-activating dopamine receptor signaling pathway / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / GPER1 signaling / GDP binding / cellular response to prostaglandin E stimulus / Inactivation, recovery and regulation of the phototransduction cascade / G-protein beta-subunit binding / heterotrimeric G-protein complex / G alpha (12/13) signalling events / extracellular vesicle / integrin binding / signaling receptor complex adaptor activity / Thrombin signalling through proteinase activated receptors (PARs) / GTPase binding / retina development in camera-type eye / Ca2+ pathway / cell cortex / phospholipase C-activating G protein-coupled receptor signaling pathway / cellular response to hypoxia / midbody / G alpha (i) signalling events / fibroblast proliferation / G alpha (s) signalling events / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / basolateral plasma membrane / G alpha (q) signalling events / transmembrane transporter binding / Ras protein signal transduction / cell population proliferation / Extra-nuclear estrogen signaling 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||
 データ登録者 データ登録者 | Zuo H / Park J / Frangaj A / Ye J / Lu G / Manning JJ / Asher WB / Lu Z / Hu G / Wang L ...Zuo H / Park J / Frangaj A / Ye J / Lu G / Manning JJ / Asher WB / Lu Z / Hu G / Wang L / Mendez J / Eng E / Zhang Z / Lin X / Grasucci R / Hendrickson WA / Clarke OB / Javitch JA / Conigrave AD / Fan QR | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2024 ジャーナル: Nature / 年: 2024タイトル: Promiscuous G-protein activation by the calcium-sensing receptor. 著者: Hao Zuo / Jinseo Park / Aurel Frangaj / Jianxiang Ye / Guanqi Lu / Jamie J Manning / Wesley B Asher / Zhengyuan Lu / Guo-Bin Hu / Liguo Wang / Joshua Mendez / Edward Eng / Zhening Zhang / Xin ...著者: Hao Zuo / Jinseo Park / Aurel Frangaj / Jianxiang Ye / Guanqi Lu / Jamie J Manning / Wesley B Asher / Zhengyuan Lu / Guo-Bin Hu / Liguo Wang / Joshua Mendez / Edward Eng / Zhening Zhang / Xin Lin / Robert Grassucci / Wayne A Hendrickson / Oliver B Clarke / Jonathan A Javitch / Arthur D Conigrave / Qing R Fan /   要旨: The human calcium-sensing receptor (CaSR) detects fluctuations in the extracellular Ca concentration and maintains Ca homeostasis. It also mediates diverse cellular processes not associated with Ca ...The human calcium-sensing receptor (CaSR) detects fluctuations in the extracellular Ca concentration and maintains Ca homeostasis. It also mediates diverse cellular processes not associated with Ca balance. The functional pleiotropy of CaSR arises in part from its ability to signal through several G-protein subtypes. We determined structures of CaSR in complex with G proteins from three different subfamilies: G, G and G. We found that the homodimeric CaSR of each complex couples to a single G protein through a common mode. This involves the C-terminal helix of each Gα subunit binding to a shallow pocket that is formed in one CaSR subunit by all three intracellular loops (ICL1-ICL3), an extended transmembrane helix 3 and an ordered C-terminal region. G-protein binding expands the transmembrane dimer interface, which is further stabilized by phospholipid. The restraint imposed by the receptor dimer, in combination with ICL2, enables G-protein activation by facilitating conformational transition of Gα. We identified a single Gα residue that determines G and G versus G selectivity. The length and flexibility of ICL2 allows CaSR to bind all three Gα subtypes, thereby conferring capacity for promiscuous G-protein coupling. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_43811.map.gz emd_43811.map.gz | 10.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-43811-v30.xml emd-43811-v30.xml emd-43811.xml emd-43811.xml | 27.6 KB 27.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_43811.png emd_43811.png | 99.2 KB | ||
| Filedesc metadata |  emd-43811.cif.gz emd-43811.cif.gz | 8.6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-43811 http://ftp.pdbj.org/pub/emdb/structures/EMD-43811 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-43811 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-43811 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_43811_validation.pdf.gz emd_43811_validation.pdf.gz | 343.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_43811_full_validation.pdf.gz emd_43811_full_validation.pdf.gz | 343.2 KB | 表示 | |
| XML形式データ |  emd_43811_validation.xml.gz emd_43811_validation.xml.gz | 7.8 KB | 表示 | |
| CIF形式データ |  emd_43811_validation.cif.gz emd_43811_validation.cif.gz | 8.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43811 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43811 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43811 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43811 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_43811.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_43811.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Human CaSR-miniGis complex in nanodiscs, composite map of locally refined CaSR ECD, CaSR TMD and G protein | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.825 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
+全体 : Human CaSR in complex with chimeric Gq (miniGisq) protein
+超分子 #1: Human CaSR in complex with chimeric Gq (miniGisq) protein
+分子 #1: Isoform 1 of Extracellular calcium-sensing receptor
+分子 #2: Chimeric mini guanine nucleotide-binding protein G(i)(s)(q) subun...
+分子 #3: Guanine nucleotide-binding protein G(I)/G(S)/G(T) subunit beta-1
+分子 #4: Chimeric mini guanine nucleotide-binding protein G(i)(s)(q) subun...
+分子 #6: 2-acetamido-2-deoxy-beta-D-glucopyranose
+分子 #7: CYCLOMETHYLTRYPTOPHAN
+分子 #8: PHOSPHATE ION
+分子 #9: CALCIUM ION
+分子 #10: 3-(2-chlorophenyl)-N-[(1R)-1-(3-methoxyphenyl)ethyl]propan-1-amine
+分子 #11: CHOLESTEROL HEMISUCCINATE
+分子 #12: (19R,22S,25R)-22,25,26-trihydroxy-16,22-dioxo-17,21,23-trioxa-22l...
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 3.6 mg/mL | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||||||||||||||
| グリッド | モデル: Quantifoil R0.6/1 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 50 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 25 sec. / 前処理 - 雰囲気: OTHER | |||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV 詳細: The sample was blotted for 6s before plunge-frozen.. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最高: 100.0 K |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 15 eV |
| ソフトウェア | 名称: EPU |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) デジタル化 - サイズ - 横: 11520 pixel / デジタル化 - サイズ - 縦: 8184 pixel / 撮影したグリッド数: 1 / 実像数: 9336 / 平均露光時間: 3.0 sec. / 平均電子線量: 74.9 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm 最大 デフォーカス(公称値): 1.9000000000000001 µm 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル |
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ソフトウェア | 名称:  Coot (ver. 0.9.8.1) Coot (ver. 0.9.8.1) | ||||||||||||
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT | ||||||||||||
| 得られたモデル |  PDB-9asb: |
 ムービー
ムービー コントローラー
コントローラー


























































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)