+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Feline Calicivirus Strain F9 | |||||||||
 マップデータ マップデータ | Icosahedral reconstruction of feline calicivirus strain F9 | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Capsid / Calicivirus / Vesivirus / Vp1 / VIRUS | |||||||||
| 機能・相同性 | T=3 icosahedral viral capsid / Calicivirus coat protein / Calicivirus coat protein / Picornavirus/Calicivirus coat protein / Viral coat protein subunit / Capsid protein VP1 機能・相同性情報 機能・相同性情報 | |||||||||
| 生物種 |  Feline calicivirus (ウイルス) Feline calicivirus (ウイルス) | |||||||||
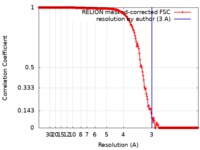
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.0 Å | |||||||||
 データ登録者 データ登録者 | Conley MJ / Bhella D | |||||||||
| 資金援助 |  英国, 2件 英国, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2019 ジャーナル: Nature / 年: 2019タイトル: Calicivirus VP2 forms a portal-like assembly following receptor engagement. 著者: Michaela J Conley / Marion McElwee / Liyana Azmi / Mads Gabrielsen / Olwyn Byron / Ian G Goodfellow / David Bhella /  要旨: To initiate infection, many viruses enter their host cells by triggering endocytosis following receptor engagement. However, the mechanisms by which non-enveloped viruses escape the endosome are ...To initiate infection, many viruses enter their host cells by triggering endocytosis following receptor engagement. However, the mechanisms by which non-enveloped viruses escape the endosome are poorly understood. Here we present near-atomic-resolution cryo-electron microscopy structures for feline calicivirus both undecorated and labelled with a soluble fragment of its cellular receptor, feline junctional adhesion molecule A. We show that VP2, a minor capsid protein encoded by all caliciviruses, forms a large portal-like assembly at a unique three-fold axis of symmetry, following receptor engagement. This assembly-which was not detected in undecorated virions-is formed of twelve copies of VP2, arranged with their hydrophobic N termini pointing away from the virion surface. Local rearrangement at the portal site leads to the opening of a pore in the capsid shell. We hypothesize that the portal-like assembly functions as a channel for the delivery of the calicivirus genome, through the endosomal membrane, into the cytoplasm of a host cell, thereby initiating infection. VP2 was previously known to be critical for the production of infectious virus; our findings provide insights into its structure and function that advance our understanding of the Caliciviridae. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|---|
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_0054.map.gz emd_0054.map.gz | 480.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-0054-v30.xml emd-0054-v30.xml emd-0054.xml emd-0054.xml | 12.8 KB 12.8 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_0054_fsc.xml emd_0054_fsc.xml | 17.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_0054.png emd_0054.png | 226.5 KB | ||
| Filedesc metadata |  emd-0054.cif.gz emd-0054.cif.gz | 6 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-0054 http://ftp.pdbj.org/pub/emdb/structures/EMD-0054 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0054 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-0054 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_0054_validation.pdf.gz emd_0054_validation.pdf.gz | 274.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_0054_full_validation.pdf.gz emd_0054_full_validation.pdf.gz | 273.5 KB | 表示 | |
| XML形式データ |  emd_0054_validation.xml.gz emd_0054_validation.xml.gz | 15.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0054 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0054 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0054 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-0054 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  6gshMC  0056C  6gsiC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| 電子顕微鏡画像生データ |  EMPIAR-10192 (タイトル: Calicivirus VP2 forms a portal to mediate endosome escape EMPIAR-10192 (タイトル: Calicivirus VP2 forms a portal to mediate endosome escapeData size: 324.9 Data #1: Motion corrected micrographs of feline calicivirus strain F9 [micrographs - single frame]) |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_0054.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_0054.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Icosahedral reconstruction of feline calicivirus strain F9 | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.065 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : T=3 Icosahedral Capsid.
| 全体 | 名称: T=3 Icosahedral Capsid. |
|---|---|
| 要素 |
|
-超分子 #1: T=3 Icosahedral Capsid.
| 超分子 | 名称: T=3 Icosahedral Capsid. / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 / 詳細: T=3 Icosahedral Capsid |
|---|---|
| 由来(天然) | 生物種:  Feline calicivirus (ウイルス) Feline calicivirus (ウイルス) |
-分子 #1: VP1
| 分子 | 名称: VP1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 3 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Feline calicivirus (ウイルス) Feline calicivirus (ウイルス) |
| 分子量 | 理論値: 73.346664 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MCSTCANVLK YYNWDPHFRL VIDPNKFLSV GFCDNPLMCC YPELLPEFGT VWDCDQSPLQ IYLESILGDD EWASTYEAID PAVPPMHWD AAGKIFQPHP GVLMHHLIGE VAKAWDPNLP MFRLEADGDG SITAPEQGTP VGGVIAEPSA QMSAAADMAT G KSVDSEWE ...文字列: MCSTCANVLK YYNWDPHFRL VIDPNKFLSV GFCDNPLMCC YPELLPEFGT VWDCDQSPLQ IYLESILGDD EWASTYEAID PAVPPMHWD AAGKIFQPHP GVLMHHLIGE VAKAWDPNLP MFRLEADGDG SITAPEQGTP VGGVIAEPSA QMSAAADMAT G KSVDSEWE AFFSFHTSVN WSTSETQGKI LFKQSLGPLL NPYLEHLAKL YVAWSGSIDV RFSISGSGVF GGKLAAIVVP PG VDPVQST SMLQYPHVLF DARQVEPVIF SIPDLRSTLY HLMSDTDTTS LVIMVYNDLI NPYANDSNSS GCIVTVETKP GAD FKFHLL KPPGSMLTHG SVPSDLIPKS SSLWIGNRHW TDITDFVIRP FVFQANRHFD FNQETAGWST PRYRPITITI SEKN GAKLG IGVATDYIVP GIPDGWPDTT IPEKLTPAGD YAITNKSGND ITTAAGYDGA DVIVNNTNFK GMYICGSLQR AWGDK KISN TAFITTATKV DNAIEPSNVI DMTKIAVYQD THVGKEVQTS DDTLSLLGYT GIGEQAIGSD RDRVVRISVL PETGAR GGN HPIFYKNSIK LGYVIRSIDV FNSQILHTSR QLSLNHYLLP PDSFAVYRII DSNGSWFDIG IDSDGFSFVG VSSIGKL EF PLTASYMGIQ LAKIRLASNI RSSMTKL UniProtKB: Capsid protein VP1 |
-分子 #2: POTASSIUM ION
| 分子 | 名称: POTASSIUM ION / タイプ: ligand / ID: 2 / コピー数: 3 / 式: K |
|---|---|
| 分子量 | 理論値: 39.098 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1 mg/mL |
|---|---|
| 緩衝液 | pH: 7.2 / 詳細: Phosphate buffered saline |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV |
| 詳細 | Purified enveloped virions |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON III (4k x 4k) 検出モード: INTEGRATING / 撮影したグリッド数: 1 / 実像数: 5198 / 平均電子線量: 63.0 e/Å2 詳細: Each micrograph was recorded as a movie of 50 individual fractions with a total dose of 63 e/angstrom squared |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 倍率(公称値): 75000 |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)