+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 8esz | ||||||
|---|---|---|---|---|---|---|---|
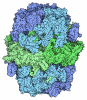
| タイトル | Structure of mitochondrial complex I from Drosophila melanogaster, Helix-locked state | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード | OXIDOREDUCTASE / NADH:ubiquinone oxidoreductase / TRANSLOCASE | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Mitochondrial protein import / Respiratory electron transport / Complex I biogenesis / Mitochondrial Fatty Acid Beta-Oxidation / RHOG GTPase cycle / Protein lipoylation / Mitochondrial protein degradation / regulation of terminal button organization / Neutrophil degranulation / mitochondrial [2Fe-2S] assembly complex ...Mitochondrial protein import / Respiratory electron transport / Complex I biogenesis / Mitochondrial Fatty Acid Beta-Oxidation / RHOG GTPase cycle / Protein lipoylation / Mitochondrial protein degradation / regulation of terminal button organization / Neutrophil degranulation / mitochondrial [2Fe-2S] assembly complex / ubiquinone-6 biosynthetic process / cellular respiration / NADH:ubiquinone reductase (H+-translocating) / mitochondrial ATP synthesis coupled electron transport / respiratory chain complex I / : / mitochondrial respiratory chain complex I assembly / mitochondrial electron transport, NADH to ubiquinone / electron transport coupled proton transport / acyl binding / acyl carrier activity / NADH dehydrogenase (ubiquinone) activity / ATP synthesis coupled electron transport / quinone binding / : / aerobic respiration / respiratory electron transport chain / proton transmembrane transport / reactive oxygen species metabolic process / determination of adult lifespan / response to reactive oxygen species / mitochondrial membrane / mitochondrial intermembrane space / 2 iron, 2 sulfur cluster binding / NAD binding / FMN binding / 4 iron, 4 sulfur cluster binding / response to oxidative stress / mitochondrial inner membrane / oxidoreductase activity / mitochondrial matrix / protein-containing complex binding / mitochondrion / metal ion binding / cytoplasm 類似検索 - 分子機能 | ||||||
| 生物種 |  | ||||||
| 手法 | 電子顕微鏡法 / 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | ||||||
 データ登録者 データ登録者 | Padavannil, A. / Letts, J.A. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Elife / 年: 2023 ジャーナル: Elife / 年: 2023タイトル: Resting mitochondrial complex I from adopts a helix-locked state. 著者: Abhilash Padavannil / Anjaneyulu Murari / Shauna-Kay Rhooms / Edward Owusu-Ansah / James A Letts /  要旨: Respiratory complex I is a proton-pumping oxidoreductase key to bioenergetic metabolism. Biochemical studies have found a divide in the behavior of complex I in metazoans that aligns with the ...Respiratory complex I is a proton-pumping oxidoreductase key to bioenergetic metabolism. Biochemical studies have found a divide in the behavior of complex I in metazoans that aligns with the evolutionary split between Protostomia and Deuterostomia. Complex I from Deuterostomia including mammals can adopt a biochemically defined off-pathway 'deactive' state, whereas complex I from Protostomia cannot. The presence of off-pathway states complicates the interpretation of structural results and has led to considerable mechanistic debate. Here, we report the structure of mitochondrial complex I from the thoracic muscles of the model protostome . We show that although complex I (-CI) does not have a NEM-sensitive deactive state, it does show slow activation kinetics indicative of an off-pathway resting state. The resting-state structure of -CI from the thoracic muscle reveals multiple conformations. We identify a helix-locked state in which an N-terminal α-helix on the NDUFS4 subunit wedges between the peripheral and membrane arms. Comparison of the -CI structure and conformational states to those observed in bacteria, yeast, and mammals provides insight into the roles of subunits across organisms, explains why the -CI off-pathway resting state is NEM insensitive, and raises questions regarding current mechanistic models of complex I turnover. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  8esz.cif.gz 8esz.cif.gz | 1.5 MB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb8esz.ent.gz pdb8esz.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  8esz.json.gz 8esz.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| 文書・要旨 |  8esz_validation.pdf.gz 8esz_validation.pdf.gz | 3.6 MB | 表示 |  wwPDB検証レポート wwPDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  8esz_full_validation.pdf.gz 8esz_full_validation.pdf.gz | 3.7 MB | 表示 | |
| XML形式データ |  8esz_validation.xml.gz 8esz_validation.xml.gz | 233.4 KB | 表示 | |
| CIF形式データ |  8esz_validation.cif.gz 8esz_validation.cif.gz | 344.9 KB | 表示 | |
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/es/8esz https://data.pdbj.org/pub/pdb/validation_reports/es/8esz ftp://data.pdbj.org/pub/pdb/validation_reports/es/8esz ftp://data.pdbj.org/pub/pdb/validation_reports/es/8esz | HTTPS FTP |
-関連構造データ
| 関連構造データ |  28582MC  8eswC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
+NADH dehydrogenase ... , 29種, 29分子 ANS6S3V2S8A8A1AOS5AMBLB6B4B7B5B9BMB8B3C2B1S4A9V3V1A7A5ALA6
-タンパク質 , 6種, 7分子 S1S7ACABB2S2A3
| #3: タンパク質 | 分子量: 78724.250 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: Q94511, NADH:ubiquinone reductase (H+-translocating) | ||||||
|---|---|---|---|---|---|---|---|
| #6: タンパク質 | 分子量: 24622.855 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: Q9VXK7 | ||||||
| #25: タンパク質 | 分子量: 17257.992 Da / 分子数: 2 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: Q94519 #30: タンパク質 | | 分子量: 10758.288 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: Q7PL91 #31: タンパク質 | | 分子量: 52985.953 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: Q9V4E0 #36: タンパク質 | | 分子量: 8412.455 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: Q9W380 |
-NADH-ubiquinone oxidoreductase chain ... , 7種, 7分子 14524L63
| #8: タンパク質 | 分子量: 36383.520 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: C7DZL9, NADH:ubiquinone reductase (H+-translocating) |
|---|---|
| #9: タンパク質 | 分子量: 51383.047 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: Q9MDK5, NADH:ubiquinone reductase (H+-translocating) |
| #10: タンパク質 | 分子量: 65777.867 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: C7DZL4, NADH:ubiquinone reductase (H+-translocating) |
| #34: タンパク質 | 分子量: 39839.887 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: P03896, NADH:ubiquinone reductase (H+-translocating) |
| #37: タンパク質 | 分子量: 11363.853 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: P18934, NADH:ubiquinone reductase (H+-translocating) |
| #38: タンパク質 | 分子量: 20083.594 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: P18933, NADH:ubiquinone reductase (H+-translocating) |
| #39: タンパク質 | 分子量: 13572.529 Da / 分子数: 1 / 由来タイプ: 天然 由来: (天然)  参照: UniProt: P18930, NADH:ubiquinone reductase (H+-translocating) |
-非ポリマー , 15種, 68分子 























| #43: 化合物 | ChemComp-CDL / #44: 化合物 | ChemComp-PC1 / #45: 化合物 | ChemComp-ZN / | #46: 化合物 | ChemComp-SF4 / #47: 化合物 | #48: 化合物 | ChemComp-3PE / #49: 化合物 | ChemComp-U10 / | #50: 化合物 | #51: 化合物 | #52: 化合物 | ChemComp-OCT / | #53: 化合物 | ChemComp-D12 / #54: 化合物 | ChemComp-NDP / | #55: 化合物 | ChemComp-FMN / | #56: 化合物 | ChemComp-WSF / ( | #57: 化合物 | ChemComp-DGT / | |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|---|
| Has protein modification | Y |
-実験情報
-実験
| 実験 | 手法: 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法: 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Mitochondrial complex I from the thoracic muscle of Drosophila melanogaster タイプ: COMPLEX / Entity ID: #1-#24, #26-#42, #25 / 由来: NATURAL |
|---|---|
| 分子量 | 実験値: NO |
| 由来(天然) | 生物種:  |
| 緩衝液 | pH: 7.7 |
| 試料 | 包埋: NO / シャドウイング: NO / 染色: NO / 凍結: YES |
| 急速凍結 | 凍結剤: ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 顕微鏡 | モデル: TFS GLACIOS |
|---|---|
| 電子銃 | 電子線源:  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 3000 nm / 最小 デフォーカス(公称値): 500 nm |
| 撮影 | 電子線照射量: 60 e/Å2 / フィルム・検出器のモデル: GATAN K3 (6k x 4k) |
- 解析
解析
| ソフトウェア | 名称: PHENIX / バージョン: 1.19.2_4158: / 分類: 精密化 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 3次元再構成 | 解像度: 3.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 293389 / 対称性のタイプ: POINT | ||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー




 PDBj
PDBj