[English] 日本語
 Yorodumi
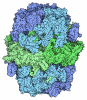
Yorodumi- PDB-8esw: Structure of mitochondrial complex I from Drosophila melanogaster... -
+ Open data
Open data
- Basic information
Basic information
| Entry | Database: PDB / ID: 8esw | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Title | Structure of mitochondrial complex I from Drosophila melanogaster, Flexible-class 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Components Components |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Keywords Keywords | OXIDOREDUCTASE / NADH:ubiquinone oxidoreductase / TRANSLOCASE | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Function / homology |  Function and homology information Function and homology informationMitochondrial protein import / Respiratory electron transport / Complex I biogenesis / Mitochondrial Fatty Acid Beta-Oxidation / : / Protein lipoylation / Mitochondrial protein degradation / Neutrophil degranulation / ubiquinone biosynthetic process / cellular respiration ...Mitochondrial protein import / Respiratory electron transport / Complex I biogenesis / Mitochondrial Fatty Acid Beta-Oxidation / : / Protein lipoylation / Mitochondrial protein degradation / Neutrophil degranulation / ubiquinone biosynthetic process / cellular respiration / Oxidoreductases / mitochondrial [2Fe-2S] assembly complex / [2Fe-2S] cluster assembly / electron transport coupled proton transport / acyl binding / NADH:ubiquinone reductase (H+-translocating) / acyl carrier activity / mitochondrial ATP synthesis coupled electron transport / mitochondrial respiratory chain complex I assembly / mitochondrial electron transport, NADH to ubiquinone / respiratory chain complex I / NADH dehydrogenase (ubiquinone) activity / quinone binding / ATP synthesis coupled electron transport / reactive oxygen species metabolic process / aerobic respiration / respiratory electron transport chain / mitochondrial intermembrane space / 2 iron, 2 sulfur cluster binding / mitochondrial membrane / Z disc / NAD binding / FMN binding / 4 iron, 4 sulfur cluster binding / oxidoreductase activity / mitochondrial inner membrane / mitochondrial matrix / protein-containing complex binding / structural molecule activity / mitochondrion / metal ion binding / cytoplasm Similarity search - Function | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Biological species |  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Method | ELECTRON MICROSCOPY / single particle reconstruction / cryo EM / Resolution: 3.3 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Authors Authors | Padavannil, A. / Letts, J.A. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Funding support |  United States, 1items United States, 1items
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Citation Citation |  Journal: Elife / Year: 2023 Journal: Elife / Year: 2023Title: Resting mitochondrial complex I from adopts a helix-locked state. Authors: Abhilash Padavannil / Anjaneyulu Murari / Shauna-Kay Rhooms / Edward Owusu-Ansah / James A Letts /  Abstract: Respiratory complex I is a proton-pumping oxidoreductase key to bioenergetic metabolism. Biochemical studies have found a divide in the behavior of complex I in metazoans that aligns with the ...Respiratory complex I is a proton-pumping oxidoreductase key to bioenergetic metabolism. Biochemical studies have found a divide in the behavior of complex I in metazoans that aligns with the evolutionary split between Protostomia and Deuterostomia. Complex I from Deuterostomia including mammals can adopt a biochemically defined off-pathway 'deactive' state, whereas complex I from Protostomia cannot. The presence of off-pathway states complicates the interpretation of structural results and has led to considerable mechanistic debate. Here, we report the structure of mitochondrial complex I from the thoracic muscles of the model protostome . We show that although complex I (-CI) does not have a NEM-sensitive deactive state, it does show slow activation kinetics indicative of an off-pathway resting state. The resting-state structure of -CI from the thoracic muscle reveals multiple conformations. We identify a helix-locked state in which an N-terminal α-helix on the NDUFS4 subunit wedges between the peripheral and membrane arms. Comparison of the -CI structure and conformational states to those observed in bacteria, yeast, and mammals provides insight into the roles of subunits across organisms, explains why the -CI off-pathway resting state is NEM insensitive, and raises questions regarding current mechanistic models of complex I turnover. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History |
|
- Structure visualization
Structure visualization
| Structure viewer | Molecule:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- Downloads & links
Downloads & links
- Download
Download
| PDBx/mmCIF format |  8esw.cif.gz 8esw.cif.gz | 1.5 MB | Display |  PDBx/mmCIF format PDBx/mmCIF format |
|---|---|---|---|---|
| PDB format |  pdb8esw.ent.gz pdb8esw.ent.gz | Display |  PDB format PDB format | |
| PDBx/mmJSON format |  8esw.json.gz 8esw.json.gz | Tree view |  PDBx/mmJSON format PDBx/mmJSON format | |
| Others |  Other downloads Other downloads |
-Validation report
| Summary document |  8esw_validation.pdf.gz 8esw_validation.pdf.gz | 3.2 MB | Display |  wwPDB validaton report wwPDB validaton report |
|---|---|---|---|---|
| Full document |  8esw_full_validation.pdf.gz 8esw_full_validation.pdf.gz | 3.3 MB | Display | |
| Data in XML |  8esw_validation.xml.gz 8esw_validation.xml.gz | 226.9 KB | Display | |
| Data in CIF |  8esw_validation.cif.gz 8esw_validation.cif.gz | 339.9 KB | Display | |
| Arichive directory |  https://data.pdbj.org/pub/pdb/validation_reports/es/8esw https://data.pdbj.org/pub/pdb/validation_reports/es/8esw ftp://data.pdbj.org/pub/pdb/validation_reports/es/8esw ftp://data.pdbj.org/pub/pdb/validation_reports/es/8esw | HTTPS FTP |
-Related structure data
| Related structure data |  28581MC  8eszC M: map data used to model this data C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
- Assembly
Assembly
| Deposited unit | 
|
|---|---|
| 1 |
|
- Components
Components
+NADH dehydrogenase ... , 29 types, 29 molecules ANS6S3V2S8A8A1AOS5AMBLB6B4B7B5B9BMB8B3C2B1S4A9V3V1A7A5A6AL
-Protein , 6 types, 7 molecules S1S7ACABB2S2A3
| #3: Protein | Mass: 78724.250 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  References: UniProt: Q94511, NADH:ubiquinone reductase (H+-translocating) | ||||||
|---|---|---|---|---|---|---|---|
| #6: Protein | Mass: 24622.855 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  | ||||||
| #26: Protein | Mass: 17257.992 Da / Num. of mol.: 2 / Source method: isolated from a natural source / Source: (natural)  #31: Protein | | Mass: 10758.288 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  #32: Protein | | Mass: 52985.953 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  #40: Protein | | Mass: 8412.455 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  |
-NADH-ubiquinone oxidoreductase chain ... , 7 types, 7 molecules 314524L6
| #8: Protein | Mass: 13572.529 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  References: UniProt: P18930, NADH:ubiquinone reductase (H+-translocating) |
|---|---|
| #9: Protein | Mass: 36383.520 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  References: UniProt: C7DZL9, NADH:ubiquinone reductase (H+-translocating) |
| #10: Protein | Mass: 51383.047 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  References: UniProt: Q9MDK5, NADH:ubiquinone reductase (H+-translocating) |
| #11: Protein | Mass: 65777.867 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  References: UniProt: C7DZL4, NADH:ubiquinone reductase (H+-translocating) |
| #35: Protein | Mass: 39839.887 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  References: UniProt: P03896, NADH:ubiquinone reductase (H+-translocating) |
| #36: Protein | Mass: 11363.853 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  References: UniProt: P18934, NADH:ubiquinone reductase (H+-translocating) |
| #37: Protein | Mass: 20083.594 Da / Num. of mol.: 1 / Source method: isolated from a natural source / Source: (natural)  References: UniProt: P18933, NADH:ubiquinone reductase (H+-translocating) |
-Non-polymers , 10 types, 49 molecules 















| #43: Chemical | ChemComp-CDL / #44: Chemical | ChemComp-ZN / | #45: Chemical | ChemComp-SF4 / #46: Chemical | #47: Chemical | ChemComp-PC1 / #48: Chemical | ChemComp-3PE / #49: Chemical | #50: Chemical | ChemComp-NDP / | #51: Chemical | ChemComp-FMN / | #52: Chemical | ChemComp-DGT / | |
|---|
-Details
| Has ligand of interest | N |
|---|---|
| Has protein modification | Y |
-Experimental details
-Experiment
| Experiment | Method: ELECTRON MICROSCOPY |
|---|---|
| EM experiment | Aggregation state: PARTICLE / 3D reconstruction method: single particle reconstruction |
- Sample preparation
Sample preparation
| Component | Name: mitochondrial complex I from the thoracic muscles of D. melanogaster Type: COMPLEX / Entity ID: #1-#42 / Source: NATURAL |
|---|---|
| Molecular weight | Experimental value: NO |
| Source (natural) | Organism:  |
| Buffer solution | pH: 7.7 |
| Specimen | Embedding applied: NO / Shadowing applied: NO / Staining applied: NO / Vitrification applied: YES |
| Vitrification | Cryogen name: ETHANE |
- Electron microscopy imaging
Electron microscopy imaging
| Microscopy | Model: TFS GLACIOS |
|---|---|
| Electron gun | Electron source:  FIELD EMISSION GUN / Accelerating voltage: 200 kV / Illumination mode: FLOOD BEAM FIELD EMISSION GUN / Accelerating voltage: 200 kV / Illumination mode: FLOOD BEAM |
| Electron lens | Mode: BRIGHT FIELD / Nominal defocus max: 3000 nm / Nominal defocus min: 500 nm |
| Image recording | Electron dose: 60 e/Å2 / Film or detector model: GATAN K3 (6k x 4k) |
- Processing
Processing
| Software | Name: PHENIX / Version: 1.19.2_4158: / Classification: refinement | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| EM software | Name: PHENIX / Category: model refinement | ||||||||||||||||||||||||
| CTF correction | Type: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||
| 3D reconstruction | Resolution: 3.3 Å / Resolution method: FSC 0.143 CUT-OFF / Num. of particles: 293389 / Symmetry type: POINT | ||||||||||||||||||||||||
| Atomic model building | Protocol: OTHER | ||||||||||||||||||||||||
| Refine LS restraints |
|
 Movie
Movie Controller
Controller



 PDBj
PDBj