| 登録情報 | データベース: PDB / ID: 7p32
|
|---|
| タイトル | Crystal structure of human lysosomal acid-alpha-glucosidase, GAA, in complex with cyclosulfamidate 6 |
|---|
 要素 要素 | Lysosomal alpha-glucosidase |
|---|
 キーワード キーワード | HYDROLASE / alpha-glycosidase / lysosomal / Pompe disease / pharmacological chaperone |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報
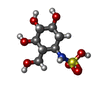
: / autolysosome lumen / maltose metabolic process / alpha-glucosidase activity / sucrose metabolic process / Glycogen storage disease type II (GAA) / alpha-1,4-glucosidase activity / alpha-glucosidase / neuromuscular process controlling posture / glycophagy ...: / autolysosome lumen / maltose metabolic process / alpha-glucosidase activity / sucrose metabolic process / Glycogen storage disease type II (GAA) / alpha-1,4-glucosidase activity / alpha-glucosidase / neuromuscular process controlling posture / glycophagy / tissue development / diaphragm contraction / regulation of the force of heart contraction / glycogen catabolic process / lysosome organization / azurophil granule membrane / aorta development / neuromuscular process controlling balance / muscle cell cellular homeostasis / Glycogen breakdown (glycogenolysis) / tertiary granule membrane / ficolin-1-rich granule membrane / heart morphogenesis / cardiac muscle contraction / lysosomal lumen / locomotory behavior / glucose metabolic process / carbohydrate binding / lysosome / lysosomal membrane / intracellular membrane-bounded organelle / Neutrophil degranulation / extracellular exosome / membrane / plasma membrane類似検索 - 分子機能 P-type trefoil, conserved site / P-type 'Trefoil' domain signature. / Trefoil (P-type) domain / P-type trefoil domain / P-type trefoil domain superfamily / P-type 'Trefoil' domain profile. / P or trefoil or TFF domain / Glycosyl hydrolases family 31, conserved site / Glycosyl hydrolases family 31 signature 2. / Glycosyl hydrolases family 31, active site ...P-type trefoil, conserved site / P-type 'Trefoil' domain signature. / Trefoil (P-type) domain / P-type trefoil domain / P-type trefoil domain superfamily / P-type 'Trefoil' domain profile. / P or trefoil or TFF domain / Glycosyl hydrolases family 31, conserved site / Glycosyl hydrolases family 31 signature 2. / Glycosyl hydrolases family 31, active site / Glycosyl hydrolases family 31 active site. / Glycoside hydrolase family 31, N-terminal domain / Glycosyl hydrolase 31 N-terminal galactose mutarotase-like domain / : / Glycosyl hydrolase family 31 C-terminal domain / Glycoside hydrolase family 31 / Glycosyl hydrolases family 31 TIM-barrel domain / Galactose mutarotase-like domain superfamily / Glycosyl hydrolase, all-beta / Glycoside hydrolase superfamily類似検索 - ドメイン・相同性 Chem-56I / TRIETHYLENE GLYCOL / Lysosomal alpha-glucosidase類似検索 - 構成要素 |
|---|
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  フーリエ合成 / 解像度: 1.82 Å フーリエ合成 / 解像度: 1.82 Å |
|---|
 データ登録者 データ登録者 | Roig-Zamboni, V. / Kok, K. / Overkleeft, H. / Artola, M. / Sulzenbacher, G. |
|---|
 引用 引用 |  ジャーナル: J.Am.Chem.Soc. / 年: 2022 ジャーナル: J.Am.Chem.Soc. / 年: 2022
タイトル: 1,6- epi-Cyclophellitol Cyclosulfamidate Is a Bona Fide Lysosomal alpha-Glucosidase Stabilizer for the Treatment of Pompe Disease.
著者: Kok, K. / Kuo, C.L. / Katzy, R.E. / Lelieveld, L.T. / Wu, L. / Roig-Zamboni, V. / van der Marel, G.A. / Codee, J.D.C. / Sulzenbacher, G. / Davies, G.J. / Overkleeft, H.S. / Aerts, J.M.F.G. / Artola, M. |
|---|
| 履歴 | | 登録 | 2021年7月6日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2022年7月13日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2022年8月31日 | Group: Database references / カテゴリ: citation / citation_author
Item: _citation.country / _citation.journal_abbrev ..._citation.country / _citation.journal_abbrev / _citation.journal_id_ASTM / _citation.journal_id_CSD / _citation.journal_id_ISSN / _citation.journal_volume / _citation.page_first / _citation.page_last / _citation.pdbx_database_id_DOI / _citation.pdbx_database_id_PubMed / _citation.title / _citation.year |
|---|
| 改定 1.2 | 2024年1月31日 | Group: Data collection / Refinement description
カテゴリ: chem_comp_atom / chem_comp_bond / pdbx_initial_refinement_model |
|---|
| 改定 2.0 | 2024年7月31日 | Group: Atomic model / Data collection ...Atomic model / Data collection / Source and taxonomy / Structure summary
カテゴリ: atom_site / chem_comp ...atom_site / chem_comp / entity_name_com / entity_src_gen / pdbx_nonpoly_scheme
Item: _atom_site.B_iso_or_equiv / _atom_site.Cartn_x ..._atom_site.B_iso_or_equiv / _atom_site.Cartn_x / _atom_site.Cartn_y / _atom_site.Cartn_z / _chem_comp.type / _entity_name_com.name / _entity_src_gen.gene_src_common_name / _pdbx_nonpoly_scheme.auth_seq_num |
|---|
| 改定 2.1 | 2024年11月13日 | Group: Structure summary
カテゴリ: pdbx_entry_details / pdbx_modification_feature
Item: _pdbx_entry_details.has_protein_modification |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  フーリエ合成 / 解像度: 1.82 Å
フーリエ合成 / 解像度: 1.82 Å  データ登録者
データ登録者 引用
引用 ジャーナル: J.Am.Chem.Soc. / 年: 2022
ジャーナル: J.Am.Chem.Soc. / 年: 2022 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 7p32.cif.gz
7p32.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb7p32.ent.gz
pdb7p32.ent.gz PDB形式
PDB形式 7p32.json.gz
7p32.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/p3/7p32
https://data.pdbj.org/pub/pdb/validation_reports/p3/7p32 ftp://data.pdbj.org/pub/pdb/validation_reports/p3/7p32
ftp://data.pdbj.org/pub/pdb/validation_reports/p3/7p32 リンク
リンク 集合体
集合体
 要素
要素 Homo sapiens (ヒト) / 遺伝子: GAA / 細胞株 (発現宿主): OVARY CELLS
Homo sapiens (ヒト) / 遺伝子: GAA / 細胞株 (発現宿主): OVARY CELLS













 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製 シンクロトロン / サイト:
シンクロトロン / サイト:  SOLEIL
SOLEIL  / ビームライン: PROXIMA 2 / 波長: 0.98009 Å
/ ビームライン: PROXIMA 2 / 波長: 0.98009 Å 解析
解析 フーリエ合成
フーリエ合成 ムービー
ムービー コントローラー
コントローラー







 PDBj
PDBj












