+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-6370 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | 3D-Structure of negatively stained Schistosome myosin filament obtained by low-dose electron microscopy | |||||||||
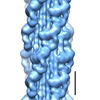
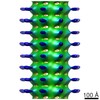
 マップデータ マップデータ | Map of Schistosome thick filaments. Initial view is from the Z-line perspective. If the map is rotated by 90 degrees in x direction, the J motif of the interacting heads is featured and the backbone subfilaments can be seen clearly. | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Schistosoma mansoni / rigid docking / single particle reconstruction / Iterative Helical Real Space Reconstruction (IHRSR) / negative stain / thick filament / smooth muscle | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報myosin complex / myofibril / cytoskeletal motor activity / actin filament binding / calcium ion binding / ATP binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
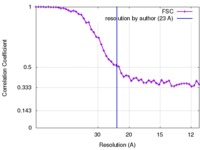
| 手法 | らせん対称体再構成法 / ネガティブ染色法 / 解像度: 23.0 Å | |||||||||
 データ登録者 データ登録者 | Sulbaran G / Alamo L / Pinto A / Marquez G / Mendez F / Padron R / Craig R | |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2015 ジャーナル: Proc Natl Acad Sci U S A / 年: 2015タイトル: An invertebrate smooth muscle with striated muscle myosin filaments. 著者: Guidenn Sulbarán / Lorenzo Alamo / Antonio Pinto / Gustavo Márquez / Franklin Méndez / Raúl Padrón / Roger Craig /   要旨: Muscle tissues are classically divided into two major types, depending on the presence or absence of striations. In striated muscles, the actin filaments are anchored at Z-lines and the myosin and ...Muscle tissues are classically divided into two major types, depending on the presence or absence of striations. In striated muscles, the actin filaments are anchored at Z-lines and the myosin and actin filaments are in register, whereas in smooth muscles, the actin filaments are attached to dense bodies and the myosin and actin filaments are out of register. The structure of the filaments in smooth muscles is also different from that in striated muscles. Here we have studied the structure of myosin filaments from the smooth muscles of the human parasite Schistosoma mansoni. We find, surprisingly, that they are indistinguishable from those in an arthropod striated muscle. This structural similarity is supported by sequence comparison between the schistosome myosin II heavy chain and known striated muscle myosins. In contrast, the actin filaments of schistosomes are similar to those of smooth muscles, lacking troponin-dependent regulation. We conclude that schistosome muscles are hybrids, containing striated muscle-like myosin filaments and smooth muscle-like actin filaments in a smooth muscle architecture. This surprising finding has broad significance for understanding how muscles are built and how they evolved, and challenges the paradigm that smooth and striated muscles always have distinctly different components. #1:  ジャーナル: BIOPHYS.J. / 年: 2014 ジャーナル: BIOPHYS.J. / 年: 2014タイトル: Schistosome Muscles Contain Striated Muscle-Like Myosin Filaments in a Smooth Muscle-Like Architecture 著者: Sulbaran G / Alamo L / Pinto A / Marquez G / Mendez F / Padron R / Craig R | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_6370.map.gz emd_6370.map.gz | 1.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-6370-v30.xml emd-6370-v30.xml emd-6370.xml emd-6370.xml | 15.5 KB 15.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_6370_fsc.xml emd_6370_fsc.xml | 5.5 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_6370.tif emd_6370.tif emd_6370_1.tif emd_6370_1.tif emd_6370_2.tif emd_6370_2.tif | 267.7 KB 285.8 KB 237.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-6370 http://ftp.pdbj.org/pub/emdb/structures/EMD-6370 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6370 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6370 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_6370_validation.pdf.gz emd_6370_validation.pdf.gz | 333.2 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_6370_full_validation.pdf.gz emd_6370_full_validation.pdf.gz | 332.8 KB | 表示 | |
| XML形式データ |  emd_6370_validation.xml.gz emd_6370_validation.xml.gz | 8.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6370 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6370 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6370 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6370 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_6370.map.gz / 形式: CCP4 / 大きさ: 8.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_6370.map.gz / 形式: CCP4 / 大きさ: 8.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Map of Schistosome thick filaments. Initial view is from the Z-line perspective. If the map is rotated by 90 degrees in x direction, the J motif of the interacting heads is featured and the backbone subfilaments can be seen clearly. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 5.7 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : Myosin thick filaments from Schistosoma mansoni smooth muscle
| 全体 | 名称: Myosin thick filaments from Schistosoma mansoni smooth muscle |
|---|---|
| 要素 |
|
-超分子 #1000: Myosin thick filaments from Schistosoma mansoni smooth muscle
| 超分子 | 名称: Myosin thick filaments from Schistosoma mansoni smooth muscle タイプ: sample / ID: 1000 詳細: S. mansoni relaxed myosin thick filaments were isolated by permeabilizing and homogenizing whole animals in relaxing solution, centrifuged, and resuspended in blebbistatin. 集合状態: polymer of myosin II molecules helically assembled over a paramyosin core Number unique components: 1 |
|---|
-分子 #1: Myosin II
| 分子 | 名称: Myosin II / タイプ: protein_or_peptide / ID: 1 / Name.synonym: Myosin Type II 詳細: Myosin II is a protein complex formed by two heavy chains and two associated light chains (for each myosin head), plus additional proteins such as paramyosin. Using ATP hydrolysis, myosin ...詳細: Myosin II is a protein complex formed by two heavy chains and two associated light chains (for each myosin head), plus additional proteins such as paramyosin. Using ATP hydrolysis, myosin functions as a molecular motor, producing movement by causing actin filaments to slide. コピー数: 1 集合状態: polymer of myosin II molecules helically assembled over a paramyosin core 組換発現: No / データベース: NCBI |
|---|---|
| 由来(天然) | 生物種:  |
| 配列 | UniProtKB: Myosin heavy chain GO: myosin complex, cytoskeletal motor activity, ATP binding InterPro: Myosin, N-terminal, SH3-like, P-loop containing nucleoside triphosphate hydrolase, Myosin head, motor domain, INTERPRO: IPR027401, Myosin tail, IQ motif, EF-hand binding site |
-実験情報
-構造解析
| 手法 | ネガティブ染色法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7 詳細: 100 mM NaCl, 3 mM MgCl2, 1 mM EGTA, 5 mM PIPES, 1mM NaN3, 5 mM MgATP, 0.01 mM blebbistatin, protease inhibitor cocktail (Sigma P-8465) |
|---|---|
| 染色 | タイプ: NEGATIVE 詳細: One drop of filament suspension was placed on grids and negatively stained with 1% uranyl acetate. |
| グリッド | 詳細: 400-mesh holey carbon grids. Specimens were imaged on thin carbon extending over the holes. |
| 凍結 | 凍結剤: NONE / 装置: OTHER |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI/PHILIPS CM120T |
|---|---|
| アライメント法 | Legacy - 非点収差: Objective lens astigmatism was corrected at 240,000 times magnification |
| 詳細 | 1.5 post-magnification, low-dose conditions |
| 日付 | 2013年3月1日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: TVIPS TEMCAM-F224 (2k x 2k) 実像数: 263 / 平均電子線量: 10 e/Å2 詳細: Images were acquired with a 2K x 2K CCD TVIPS camera model F224HD at 5.7 A/pixel. ビット/ピクセル: 16 |
| 電子線 | 加速電圧: 80 kV / 電子線源: LAB6 |
| 電子光学系 | 倍率(補正後): 42000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.0 mm / 最大 デフォーカス(公称値): 2.4 µm / 最小 デフォーカス(公称値): 0.6 µm / 倍率(公称値): 42000 |
| 試料ステージ | 試料ホルダー: Room temperature holder / 試料ホルダーモデル: SIDE ENTRY, EUCENTRIC |
- 画像解析
画像解析
-原子モデル構築 1
| 初期モデル | PDB ID: Chain - #0 - Chain ID: A / Chain - #1 - Chain ID: B / Chain - #2 - Chain ID: C / Chain - #3 - Chain ID: D / Chain - #4 - Chain ID: E / Chain - #5 - Chain ID: F |
|---|---|
| ソフトウェア | 名称:  Chimera Chimera |
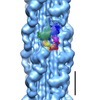
| 詳細 | 3DTP was fitted as a rigid body using the "Fit in Map" tool of UCSF Chimera. |
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
| 得られたモデル |  PDB-3jax: |
 ムービー
ムービー コントローラー
コントローラー