+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-6219 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | T. acidophilum 20S proteasome | |||||||||
 マップデータ マップデータ | Reconstruction of T. acidophilum 20S proteasome, using K2 summit camera at a low magnification | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | T. acidophilum 20S proteasome | |||||||||
| 生物種 |   Thermoplasma acidophilum (好酸性) Thermoplasma acidophilum (好酸性) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.8 Å | |||||||||
 データ登録者 データ登録者 | Li X / Cheng Y | |||||||||
 引用 引用 |  ジャーナル: Nat Methods / 年: 2015 ジャーナル: Nat Methods / 年: 2015タイトル: De novo protein structure determination from near-atomic-resolution cryo-EM maps. 著者: Ray Yu-Ruei Wang / Mikhail Kudryashev / Xueming Li / Edward H Egelman / Marek Basler / Yifan Cheng / David Baker / Frank DiMaio /   要旨: We present a de novo model-building approach that combines predicted backbone conformations with side-chain fit to density to accurately assign sequence into density maps. This method yielded ...We present a de novo model-building approach that combines predicted backbone conformations with side-chain fit to density to accurately assign sequence into density maps. This method yielded accurate models for six of nine experimental maps at 3.3- to 4.8-Å resolution and produced a nearly complete model for an unsolved map containing a 660-residue heterodimeric protein. This method should enable rapid and reliable protein structure determination from near-atomic-resolution cryo-electron microscopy (cryo-EM) maps. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_6219.map.gz emd_6219.map.gz | 115.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-6219-v30.xml emd-6219-v30.xml emd-6219.xml emd-6219.xml | 8.1 KB 8.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  400_6219.gif 400_6219.gif 80_6219.gif 80_6219.gif | 56 KB 4.4 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-6219 http://ftp.pdbj.org/pub/emdb/structures/EMD-6219 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6219 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-6219 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_6219_validation.pdf.gz emd_6219_validation.pdf.gz | 78 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_6219_full_validation.pdf.gz emd_6219_full_validation.pdf.gz | 77.1 KB | 表示 | |
| XML形式データ |  emd_6219_validation.xml.gz emd_6219_validation.xml.gz | 493 B | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6219 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6219 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6219 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-6219 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_6219.map.gz / 形式: CCP4 / 大きさ: 122.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_6219.map.gz / 形式: CCP4 / 大きさ: 122.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Reconstruction of T. acidophilum 20S proteasome, using K2 summit camera at a low magnification | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.98 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
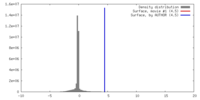
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : T. acidophilum 20S proteasome
| 全体 | 名称: T. acidophilum 20S proteasome |
|---|---|
| 要素 |
|
-超分子 #1000: T. acidophilum 20S proteasome
| 超分子 | 名称: T. acidophilum 20S proteasome / タイプ: sample / ID: 1000 / 集合状態: 28-mer / Number unique components: 1 |
|---|---|
| 分子量 | 実験値: 700 KDa / 理論値: 700 KDa |
-分子 #1: 20S proteasome
| 分子 | 名称: 20S proteasome / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 集合状態: 24-mer / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:   Thermoplasma acidophilum (好酸性) Thermoplasma acidophilum (好酸性) |
| 分子量 | 実験値: 700 KDa / 理論値: 700 KDa |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| グリッド | 詳細: Holey carbon on top of 400 mesh grid |
|---|---|
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK III |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI POLARA 300 |
|---|---|
| 詳細 | Images were recorded in dose-fractionated format using K2 Summit operated in counting and super-resolution mode. Motion correction was performed for each image. |
| 日付 | 2012年1月1日 |
| 撮影 | カテゴリ: CCD / フィルム・検出器のモデル: OTHER / 実像数: 157 / 平均電子線量: 30 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.0 mm / 最大 デフォーカス(公称値): 1.9 µm / 最小 デフォーカス(公称値): 0.8 µm / 倍率(公称値): 20000 |
| 試料ステージ | 試料ホルダーモデル: OTHER |
| 実験機器 |  モデル: Tecnai Polara / 画像提供: FEI Company |
- 画像解析
画像解析
| CTF補正 | 詳細: Each particle |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 4.8 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: FREALIGN / 使用した粒子像数: 79801 |
 ムービー
ムービー コントローラー
コントローラー














 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)