+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-5168 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Direct visualization of secondary structures of F-actin by electron cryomicroscopy | |||||||||
 マップデータ マップデータ | CryoEM map of F-actin at 6.6 angstrom resolution | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | F-actin | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cytoskeletal motor activator activity / myosin heavy chain binding / tropomyosin binding / actin filament bundle / troponin I binding / filamentous actin / mesenchyme migration / skeletal muscle myofibril / actin filament bundle assembly / striated muscle thin filament ...cytoskeletal motor activator activity / myosin heavy chain binding / tropomyosin binding / actin filament bundle / troponin I binding / filamentous actin / mesenchyme migration / skeletal muscle myofibril / actin filament bundle assembly / striated muscle thin filament / skeletal muscle thin filament assembly / actin monomer binding / skeletal muscle fiber development / stress fiber / titin binding / actin filament polymerization / filopodium / actin filament / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / calcium-dependent protein binding / lamellipodium / cell body / hydrolase activity / protein domain specific binding / calcium ion binding / positive regulation of gene expression / magnesium ion binding / ATP binding / identical protein binding / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 | unidentified (未定義) | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 6.6 Å | |||||||||
 データ登録者 データ登録者 | Fujii T / Iwane AH / Yanagida T / Namba K | |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2010 ジャーナル: Nature / 年: 2010タイトル: Direct visualization of secondary structures of F-actin by electron cryomicroscopy. 著者: Takashi Fujii / Atsuko H Iwane / Toshio Yanagida / Keiichi Namba /  要旨: F-actin is a helical assembly of actin, which is a component of muscle fibres essential for contraction and has a crucial role in numerous cellular processes, such as the formation of lamellipodia ...F-actin is a helical assembly of actin, which is a component of muscle fibres essential for contraction and has a crucial role in numerous cellular processes, such as the formation of lamellipodia and filopodia, as the most abundant component and regulator of cytoskeletons by dynamic assembly and disassembly (from G-actin to F-actin and vice versa). Actin is a ubiquitous protein and is involved in important biological functions, but the definitive high-resolution structure of F-actin remains unknown. Although a recent atomic model well reproduced X-ray fibre diffraction intensity data from a highly oriented liquid-crystalline sol specimen, its refinement without experimental phase information has certain limitations. Direct visualization of the structure by electron cryomicroscopy, however, has been difficult because it is relatively thin and flexible. Here we report the F-actin structure at 6.6 Å resolution, made obtainable by recent advances in electron cryomicroscopy. The density map clearly resolves all the secondary structures of G-actin, such as α-helices, β-structures and loops, and makes unambiguous modelling and refinement possible. Complex domain motions that open the nucleotide-binding pocket on F-actin formation, specific D-loop and terminal conformations, and relatively tight axial but markedly loose interprotofilament interactions hydrophilic in nature are revealed in the F-actin model, and all seem to be important for dynamic functions of actin. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_5168.map.gz emd_5168.map.gz | 3.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-5168-v30.xml emd-5168-v30.xml emd-5168.xml emd-5168.xml | 9.4 KB 9.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_5168_1.jpg emd_5168_1.jpg | 47.8 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-5168 http://ftp.pdbj.org/pub/emdb/structures/EMD-5168 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5168 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-5168 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_5168_validation.pdf.gz emd_5168_validation.pdf.gz | 344.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_5168_full_validation.pdf.gz emd_5168_full_validation.pdf.gz | 344.4 KB | 表示 | |
| XML形式データ |  emd_5168_validation.xml.gz emd_5168_validation.xml.gz | 5.4 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5168 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5168 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5168 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-5168 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_5168.map.gz / 形式: CCP4 / 大きさ: 3.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_5168.map.gz / 形式: CCP4 / 大きさ: 3.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CryoEM map of F-actin at 6.6 angstrom resolution | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.742 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
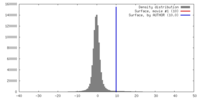
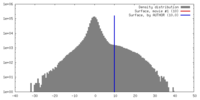
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : F-actin
| 全体 | 名称: F-actin |
|---|---|
| 要素 |
|
-超分子 #1000: F-actin
| 超分子 | 名称: F-actin / タイプ: sample / ID: 1000 / 集合状態: helical structure / Number unique components: 7 |
|---|
-分子 #1: F-actin
| 分子 | 名称: F-actin / タイプ: protein_or_peptide / ID: 1 / Name.synonym: F-actin / 組換発現: No / データベース: NCBI |
|---|---|
| 由来(天然) | 生物種: unidentified (未定義) / 別称: rabbit |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | filament |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 詳細: 25 mM Hepes buffer (pH 7.5), 50 mM KCl, 1 mM MgCl2 and 1 mM ATP |
|---|---|
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / 装置: OTHER / 詳細: Vitrification instrument: Vitrobot / 手法: Blot for 3.5 seconds before plunging |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 3200FSC |
|---|---|
| 温度 | 平均: 50 K |
| 特殊光学系 | エネルギーフィルター - 名称: Omega filter エネルギーフィルター - エネルギー下限: 0.0 eV エネルギーフィルター - エネルギー上限: 10.0 eV |
| 日付 | 2009年3月21日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: TVIPS TEMCAM-F415 (4k x 4k) デジタル化 - サンプリング間隔: 15 µm / 実像数: 490 / 平均電子線量: 20 e/Å2 / ビット/ピクセル: 16 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 倍率(補正後): 172000 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 1.6 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 100000 |
| 試料ステージ | 試料ホルダー: Top entry liquid helium-cooled cryo specimen holder 試料ホルダーモデル: JEOL 3200FSC CRYOHOLDER |
- 画像解析
画像解析
| 詳細 | 1-start helix (166.6 degree, 27.6 angstrom) is left handed. F-actin looks like a two strand ribbon. The long pitch helix along the strand of F-actin is right handed. |
|---|---|
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 27.6 Å 想定した対称性 - らせんパラメータ - ΔΦ: 166.6 ° 解像度のタイプ: BY AUTHOR / 解像度: 6.6 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: SPIDER |
| CTF補正 | 詳細: Each particle |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)