+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of the human TWIK-2 potassium channel in complex with pimozide | |||||||||
 マップデータ マップデータ | TWIK2 bound to pimozide | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Two-pore potassium channel K2P6 TWIK2 K2P channel pimozide drug NLRP3 inflammasome / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報regulation of lysosome size / Tandem of pore domain in a weak inwardly rectifying K+ channels (TWIK) / Phase 4 - resting membrane potential / potassium ion leak channel activity / regulation of resting membrane potential / inward rectifier potassium channel activity / negative regulation of systemic arterial blood pressure / outward rectifier potassium channel activity / positive regulation of NLRP3 inflammasome complex assembly / potassium channel activity ...regulation of lysosome size / Tandem of pore domain in a weak inwardly rectifying K+ channels (TWIK) / Phase 4 - resting membrane potential / potassium ion leak channel activity / regulation of resting membrane potential / inward rectifier potassium channel activity / negative regulation of systemic arterial blood pressure / outward rectifier potassium channel activity / positive regulation of NLRP3 inflammasome complex assembly / potassium channel activity / voltage-gated potassium channel complex / potassium ion transmembrane transport / potassium ion transport / late endosome membrane / lysosomal membrane / metal ion binding / plasma membrane 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.17 Å | |||||||||
 データ登録者 データ登録者 | Khanra NK / Long SB | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2025 ジャーナル: Proc Natl Acad Sci U S A / 年: 2025タイトル: Structure of the human TWIK-2 potassium channel and its inhibition by pimozide. 著者: Nandish K Khanra / Chongyuan Wang / Bryce D Delgado / Stephen B Long /  要旨: The potassium channel TWIK-2 is crucial for ATP-induced activation of the NLRP3 inflammasome in macrophages. The channel is a member of the two-pore domain potassium (K2P) channel superfamily and an ...The potassium channel TWIK-2 is crucial for ATP-induced activation of the NLRP3 inflammasome in macrophages. The channel is a member of the two-pore domain potassium (K2P) channel superfamily and an emerging therapeutic target to mitigate severe inflammatory injury involving NLRP3 activation. We report the cryo-EM structure of human TWIK-2. In comparison to other K2P channels, the structure reveals an unusual "up" conformation of Tyr111 in the selectivity filter and a resulting SF1-P1 pocket behind the filter. Density for acyl chains is present in fenestrations within the transmembrane region that connects the central cavity of the pore to the lipid membrane. Despite its importance as a drug target, limited pharmacological tools are available for TWIK-2. A previous study suggested that the FDA-approved small molecule pimozide might inhibit TWIK-2. Using a reconstituted system, we show that pimozide directly inhibits the channel and we determine a cryo-EM structure of a complex with the drug. Pimozide displaces the acyl chains within the fenestrations and binds below the selectivity filter where it would impede ion permeation. The drug may access its binding site by lateral diffusion in the membrane, suggesting that other hydrophobic small molecules could have utility for inhibiting TWIK-2. The work defines the structure of TWIK-2 and provides a structural foundation for development of more specific inhibitors with potential utility as anti-inflammatory drugs. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_48217.map.gz emd_48217.map.gz | 203.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-48217-v30.xml emd-48217-v30.xml emd-48217.xml emd-48217.xml | 21.3 KB 21.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_48217_fsc.xml emd_48217_fsc.xml | 12.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_48217.png emd_48217.png | 67.1 KB | ||
| Filedesc metadata |  emd-48217.cif.gz emd-48217.cif.gz | 7 KB | ||
| その他 |  emd_48217_half_map_1.map.gz emd_48217_half_map_1.map.gz emd_48217_half_map_2.map.gz emd_48217_half_map_2.map.gz | 200.5 MB 200.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-48217 http://ftp.pdbj.org/pub/emdb/structures/EMD-48217 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-48217 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-48217 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_48217_validation.pdf.gz emd_48217_validation.pdf.gz | 834.1 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_48217_full_validation.pdf.gz emd_48217_full_validation.pdf.gz | 833.5 KB | 表示 | |
| XML形式データ |  emd_48217_validation.xml.gz emd_48217_validation.xml.gz | 21.6 KB | 表示 | |
| CIF形式データ |  emd_48217_validation.cif.gz emd_48217_validation.cif.gz | 28.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-48217 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-48217 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-48217 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-48217 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  9melMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_48217.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_48217.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | TWIK2 bound to pimozide | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.725 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: TWIK2 bound to pimozide
| ファイル | emd_48217_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | TWIK2 bound to pimozide | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: TWIK2 bound to pimozide
| ファイル | emd_48217_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | TWIK2 bound to pimozide | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : human TWIK-2 potassium channel in complex with pimozide
| 全体 | 名称: human TWIK-2 potassium channel in complex with pimozide |
|---|---|
| 要素 |
|
-超分子 #1: human TWIK-2 potassium channel in complex with pimozide
| 超分子 | 名称: human TWIK-2 potassium channel in complex with pimozide タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 詳細: human TWIK-2 potassium channel in complex with pimozide |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 33.74728 KDa |
-分子 #1: Potassium channel subfamily K member 6
| 分子 | 名称: Potassium channel subfamily K member 6 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 33.775113 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MRRGALLAGA LAAYAAYLVL GALLVARLEG PHEARLRAEL ETLRAQLLQR SPCVAAPALD AFVERVLAAG RLGRVVLANA SGSANASDP AWDFASALFF ASTLITTVGY GYTTPLTDAG KAFSIAFALL GVPTTMLLLT ASAQRLSLLL THVPLSWLSM R WGWDPRRA ...文字列: MRRGALLAGA LAAYAAYLVL GALLVARLEG PHEARLRAEL ETLRAQLLQR SPCVAAPALD AFVERVLAAG RLGRVVLANA SGSANASDP AWDFASALFF ASTLITTVGY GYTTPLTDAG KAFSIAFALL GVPTTMLLLT ASAQRLSLLL THVPLSWLSM R WGWDPRRA ACWHLVALLG VVVTVCFLVP AVIFAHLEEA WSFLDAFYFC FISLSTIGLG DYVPGEAPGQ PYRALYKVLV TV YLFLGLV AMVLVLQTFR HVSDLHGLTE LILLPPPCPA SFNADEDDRV DILGPQPESH QQLSASSHTD YASIPR UniProtKB: Potassium channel subfamily K member 6 |
-分子 #2: POTASSIUM ION
| 分子 | 名称: POTASSIUM ION / タイプ: ligand / ID: 2 / コピー数: 3 / 式: K |
|---|---|
| 分子量 | 理論値: 39.098 Da |
-分子 #3: 3-[1-[4,4-bis(4-fluorophenyl)butyl]piperidin-4-yl]-1~{H}-benzimid...
| 分子 | 名称: 3-[1-[4,4-bis(4-fluorophenyl)butyl]piperidin-4-yl]-1~{H}-benzimidazol-2-one タイプ: ligand / ID: 3 / コピー数: 1 / 式: 1II |
|---|---|
| 分子量 | 理論値: 461.546 Da |
| Chemical component information | 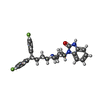 ChemComp-1II: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 構成要素:
詳細: 20 mM HEPES, 150 mM KCl, pH 7.5, 0.01 % LMNG, 0.001 % CHS, 0.0033 % GDN, 0.5 mM pimozide | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: GOLD / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY | |||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / チャンバー内温度: 277.15 K / 装置: FEI VITROBOT MARK IV 詳細: 4.0 uL sample, blot time = 3.0 sec, blot force = 0. | |||||||||||||||||||||
| 詳細 | Monodisperse recombinantly purified TWIK2 bound to pimozide |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: TFS FALCON 4i (4k x 4k) 平均電子線量: 51.38 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 165000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 温度因子: 124.2 |
|---|---|
| 得られたモデル |  PDB-9mel: |
 ムービー
ムービー コントローラー
コントローラー






 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)





































