+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Local refinement map of CaSR transmembrane domain (TMD) in detergent-solubilized human CaSR-miniGisq complex | |||||||||
 マップデータ マップデータ | Local refinement map of CaSR transmembrane domain (TMD) in detergent-solubilized human CaSR-miniGisq complex | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Calcium-sensing receptor / G-protein-coupled receptor / G protein / signal transduction / MEMBRANE PROTEIN | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.3 Å | |||||||||
 データ登録者 データ登録者 | Zuo H / Park J / Frangaj A / Ye J / Lu G / Manning JJ / Asher WB / Lu Z / Hu G / Wang L ...Zuo H / Park J / Frangaj A / Ye J / Lu G / Manning JJ / Asher WB / Lu Z / Hu G / Wang L / Mendez J / Eng E / Zhang Z / Lin X / Grasucci R / Hendrickson WA / Clarke OB / Javitch JA / Conigrave AD / Fan QR | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2024 ジャーナル: Nature / 年: 2024タイトル: Promiscuous G-protein activation by the calcium-sensing receptor. 著者: Hao Zuo / Jinseo Park / Aurel Frangaj / Jianxiang Ye / Guanqi Lu / Jamie J Manning / Wesley B Asher / Zhengyuan Lu / Guo-Bin Hu / Liguo Wang / Joshua Mendez / Edward Eng / Zhening Zhang / Xin ...著者: Hao Zuo / Jinseo Park / Aurel Frangaj / Jianxiang Ye / Guanqi Lu / Jamie J Manning / Wesley B Asher / Zhengyuan Lu / Guo-Bin Hu / Liguo Wang / Joshua Mendez / Edward Eng / Zhening Zhang / Xin Lin / Robert Grassucci / Wayne A Hendrickson / Oliver B Clarke / Jonathan A Javitch / Arthur D Conigrave / Qing R Fan /   要旨: The human calcium-sensing receptor (CaSR) detects fluctuations in the extracellular Ca concentration and maintains Ca homeostasis. It also mediates diverse cellular processes not associated with Ca ...The human calcium-sensing receptor (CaSR) detects fluctuations in the extracellular Ca concentration and maintains Ca homeostasis. It also mediates diverse cellular processes not associated with Ca balance. The functional pleiotropy of CaSR arises in part from its ability to signal through several G-protein subtypes. We determined structures of CaSR in complex with G proteins from three different subfamilies: G, G and G. We found that the homodimeric CaSR of each complex couples to a single G protein through a common mode. This involves the C-terminal helix of each Gα subunit binding to a shallow pocket that is formed in one CaSR subunit by all three intracellular loops (ICL1-ICL3), an extended transmembrane helix 3 and an ordered C-terminal region. G-protein binding expands the transmembrane dimer interface, which is further stabilized by phospholipid. The restraint imposed by the receptor dimer, in combination with ICL2, enables G-protein activation by facilitating conformational transition of Gα. We identified a single Gα residue that determines G and G versus G selectivity. The length and flexibility of ICL2 allows CaSR to bind all three Gα subtypes, thereby conferring capacity for promiscuous G-protein coupling. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_43963.map.gz emd_43963.map.gz | 256 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-43963-v30.xml emd-43963-v30.xml emd-43963.xml emd-43963.xml | 23.4 KB 23.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_43963_fsc.xml emd_43963_fsc.xml | 17 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_43963.png emd_43963.png | 102.4 KB | ||
| Filedesc metadata |  emd-43963.cif.gz emd-43963.cif.gz | 5.5 KB | ||
| その他 |  emd_43963_half_map_1.map.gz emd_43963_half_map_1.map.gz emd_43963_half_map_2.map.gz emd_43963_half_map_2.map.gz | 475.1 MB 475.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-43963 http://ftp.pdbj.org/pub/emdb/structures/EMD-43963 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-43963 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-43963 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_43963_validation.pdf.gz emd_43963_validation.pdf.gz | 1.1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_43963_full_validation.pdf.gz emd_43963_full_validation.pdf.gz | 1.1 MB | 表示 | |
| XML形式データ |  emd_43963_validation.xml.gz emd_43963_validation.xml.gz | 26.5 KB | 表示 | |
| CIF形式データ |  emd_43963_validation.cif.gz emd_43963_validation.cif.gz | 34.6 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43963 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43963 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43963 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-43963 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_43963.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_43963.map.gz / 形式: CCP4 / 大きさ: 512 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Local refinement map of CaSR transmembrane domain (TMD) in detergent-solubilized human CaSR-miniGisq complex | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.844 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: CaSR TMD Local refinement half map A of CaSR-miniGisq in detergent
| ファイル | emd_43963_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CaSR TMD Local refinement half map A of CaSR-miniGisq in detergent | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
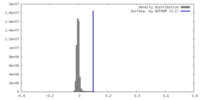
| 密度ヒストグラム |
-ハーフマップ: CaSR TMD Local refinement half map B of CaSR-miniGisq in detergent
| ファイル | emd_43963_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | CaSR TMD Local refinement half map B of CaSR-miniGisq in detergent | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
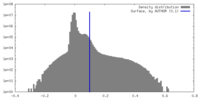
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Human CaSR in complex with chimeric Gq (miniGisq) protein
| 全体 | 名称: Human CaSR in complex with chimeric Gq (miniGisq) protein |
|---|---|
| 要素 |
|
-超分子 #1: Human CaSR in complex with chimeric Gq (miniGisq) protein
| 超分子 | 名称: Human CaSR in complex with chimeric Gq (miniGisq) protein タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#6 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 319 KDa |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 3.0 mg/mL | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
| |||||||||||||||||||||||||||
| グリッド | モデル: Quantifoil R0.6/1 / 材質: GOLD / メッシュ: 300 / 支持フィルム - 材質: GOLD / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 50 / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 25 sec. / 前処理 - 雰囲気: OTHER | |||||||||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK IV 詳細: The sample was blotted for 6s before plunge-frozen.. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最高: 100.0 K |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Bioquantum / エネルギーフィルター - スリット幅: 20 eV |
| ソフトウェア | 名称: Leginon (ver. 3.6) |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) デジタル化 - サイズ - 横: 5760 pixel / デジタル化 - サイズ - 縦: 4092 pixel / 撮影したグリッド数: 1 / 実像数: 16017 / 平均露光時間: 2.5 sec. / 平均電子線量: 70.2 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 100.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.2 µm / 倍率(公称値): 105000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 初期モデル |
| ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ソフトウェア | 名称:  Coot (ver. 0.9.8.1) Coot (ver. 0.9.8.1) | ||||||||||||||||
| 精密化 | 空間: REAL / プロトコル: FLEXIBLE FIT |
 ムービー
ムービー コントローラー
コントローラー

































 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)