+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-4081 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of bacterial 30S-IF1-IF2-IF3-mRNA translation pre-initiation complex (state-I) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 生物種 |   Thermus thermophilus HB8 (バクテリア) Thermus thermophilus HB8 (バクテリア) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 9.7 Å | |||||||||
 データ登録者 データ登録者 | Hussain T / Llacer JL / Wimberly BT / Ramakrishnan V | |||||||||
 引用 引用 |  ジャーナル: Cell / 年: 2016 ジャーナル: Cell / 年: 2016タイトル: Large-Scale Movements of IF3 and tRNA during Bacterial Translation Initiation. 著者: Tanweer Hussain / Jose L Llácer / Brian T Wimberly / Jeffrey S Kieft / V Ramakrishnan /   要旨: In bacterial translational initiation, three initiation factors (IFs 1-3) enable the selection of initiator tRNA and the start codon in the P site of the 30S ribosomal subunit. Here, we report 11 ...In bacterial translational initiation, three initiation factors (IFs 1-3) enable the selection of initiator tRNA and the start codon in the P site of the 30S ribosomal subunit. Here, we report 11 single-particle cryo-electron microscopy (cryoEM) reconstructions of the complex of bacterial 30S subunit with initiator tRNA, mRNA, and IFs 1-3, representing different steps along the initiation pathway. IF1 provides key anchoring points for IF2 and IF3, thereby enhancing their activities. IF2 positions a domain in an extended conformation appropriate for capturing the formylmethionyl moiety charged on tRNA. IF3 and tRNA undergo large conformational changes to facilitate the accommodation of the formylmethionyl-tRNA (fMet-tRNA(fMet)) into the P site for start codon recognition. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_4081.map.gz emd_4081.map.gz | 62 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-4081-v30.xml emd-4081-v30.xml emd-4081.xml emd-4081.xml | 16.7 KB 16.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_4081.png emd_4081.png | 156.5 KB | ||
| その他 |  emd_4081_half_map_1.map.gz emd_4081_half_map_1.map.gz emd_4081_half_map_2.map.gz emd_4081_half_map_2.map.gz | 58.6 MB 59.2 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-4081 http://ftp.pdbj.org/pub/emdb/structures/EMD-4081 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4081 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-4081 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_4081_validation.pdf.gz emd_4081_validation.pdf.gz | 386.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_4081_full_validation.pdf.gz emd_4081_full_validation.pdf.gz | 385.8 KB | 表示 | |
| XML形式データ |  emd_4081_validation.xml.gz emd_4081_validation.xml.gz | 11.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4081 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4081 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4081 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-4081 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  4073C  4074C  4075C  4076C  4077C  4078C  4079C  4080C  4082C  4083C  5lmnC  5lmoC  5lmpC  5lmqC  5lmrC  5lmsC  5lmtC  5lmuC  5lmvC C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_4081.map.gz / 形式: CCP4 / 大きさ: 67 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_4081.map.gz / 形式: CCP4 / 大きさ: 67 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.34 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
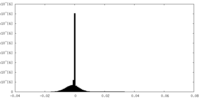
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-ハーフマップ: #1
| ファイル | emd_4081_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
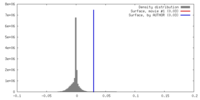
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_4081_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
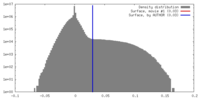
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : 30S-IF1-IF2-IF3-mRNA pre-initiation complex (state-I)
| 全体 | 名称: 30S-IF1-IF2-IF3-mRNA pre-initiation complex (state-I) |
|---|---|
| 要素 |
|
-超分子 #1: 30S-IF1-IF2-IF3-mRNA pre-initiation complex (state-I)
| 超分子 | 名称: 30S-IF1-IF2-IF3-mRNA pre-initiation complex (state-I) タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:   Thermus thermophilus HB8 (バクテリア) Thermus thermophilus HB8 (バクテリア) |
| 分子量 | 理論値: 889.3 KDa |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.065 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 6.5 構成要素:
| ||||||||||||
| グリッド | モデル: Quantifoil / 材質: COPPER / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K / 装置: FEI VITROBOT MARK I |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 温度 | 最低: 90.0 K / 最高: 100.0 K |
| 撮影 | フィルム・検出器のモデル: FEI FALCON II (4k x 4k) 撮影したグリッド数: 1 / 実像数: 3200 / 平均露光時間: 1.5 sec. / 平均電子線量: 30.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 倍率(補正後): 104478 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 3.5 µm / 最小 デフォーカス(公称値): 1.5 µm / 倍率(公称値): 59000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | 空間: RECIPROCAL / プロトコル: RIGID BODY FIT / 当てはまり具合の基準: FSC |
|---|
 ムービー
ムービー コントローラー
コントローラー











 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)