+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM structure of H. thermoluteolus GroEL-GroES2 football complex | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | Chaperone / Chaperonin / ATPase / protein folding | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報GroEL-GroES complex / chaperonin ATPase / mitochondrial unfolded protein response / protein import into mitochondrial intermembrane space / chaperone cofactor-dependent protein refolding / positive regulation of interferon-alpha production / protein folding chaperone / isomerase activity / ATP-dependent protein folding chaperone / positive regulation of interleukin-6 production ...GroEL-GroES complex / chaperonin ATPase / mitochondrial unfolded protein response / protein import into mitochondrial intermembrane space / chaperone cofactor-dependent protein refolding / positive regulation of interferon-alpha production / protein folding chaperone / isomerase activity / ATP-dependent protein folding chaperone / positive regulation of interleukin-6 production / positive regulation of type II interferon production / unfolded protein binding / positive regulation of T cell activation / protein-folding chaperone binding / response to heat / protein refolding / ATP binding / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Hydrogenophilus thermoluteolus (バクテリア) Hydrogenophilus thermoluteolus (バクテリア) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.5 Å | |||||||||
 データ登録者 データ登録者 | Liao Z / Gopalasingam CC / Kameya M / Gerle C / Shigematsu H / Ishii M / Arakawa T / Fushinobu S | |||||||||
| 資金援助 |  日本, 2件 日本, 2件
| |||||||||
 引用 引用 |  ジャーナル: Structure / 年: 2024 ジャーナル: Structure / 年: 2024タイトル: Structural insights into thermophilic chaperonin complexes. 著者: Zengwei Liao / Chai C Gopalasingam / Masafumi Kameya / Christoph Gerle / Hideki Shigematsu / Masaharu Ishii / Takatoshi Arakawa / Shinya Fushinobu /  要旨: Group I chaperonins are dual heptamer protein complexes that play significant roles in protein homeostasis. The structure and function of the Escherichia coli chaperonin are well characterized. ...Group I chaperonins are dual heptamer protein complexes that play significant roles in protein homeostasis. The structure and function of the Escherichia coli chaperonin are well characterized. However, the dynamic properties of chaperonins, such as large ATPase-dependent conformational changes by binding of lid-like co-chaperonin GroES, have made structural analyses challenging, and our understanding of these changes during the turnover of chaperonin complex formation is limited. In this study, we used single-particle cryogenic electron microscopy to investigate the structures of GroES-bound chaperonin complexes from the thermophilic hydrogen-oxidizing bacteria Hydrogenophilus thermoluteolus and Hydrogenobacter thermophilus in the presence of ATP and AMP-PNP. We captured the structure of an intermediate state chaperonin complex, designated as an asymmetric football-shaped complex, and performed analyses to decipher the dynamic structural variations. Our structural analyses of inter- and intra-subunit communications revealed a unique mechanism of complex formation through the binding of a second GroES to a bullet-shaped complex. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_37853.map.gz emd_37853.map.gz | 239.3 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-37853-v30.xml emd-37853-v30.xml emd-37853.xml emd-37853.xml | 25.6 KB 25.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_37853.png emd_37853.png | 70.5 KB | ||
| マスクデータ |  emd_37853_msk_1.map emd_37853_msk_1.map | 476.8 MB |  マスクマップ マスクマップ | |
| Filedesc metadata |  emd-37853.cif.gz emd-37853.cif.gz | 6.9 KB | ||
| その他 |  emd_37853_additional_1.map.gz emd_37853_additional_1.map.gz emd_37853_additional_2.map.gz emd_37853_additional_2.map.gz emd_37853_half_map_1.map.gz emd_37853_half_map_1.map.gz emd_37853_half_map_2.map.gz emd_37853_half_map_2.map.gz | 450.7 MB 396.3 MB 442.1 MB 442.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-37853 http://ftp.pdbj.org/pub/emdb/structures/EMD-37853 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37853 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-37853 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_37853_validation.pdf.gz emd_37853_validation.pdf.gz | 920.3 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_37853_full_validation.pdf.gz emd_37853_full_validation.pdf.gz | 919.9 KB | 表示 | |
| XML形式データ |  emd_37853_validation.xml.gz emd_37853_validation.xml.gz | 17.9 KB | 表示 | |
| CIF形式データ |  emd_37853_validation.cif.gz emd_37853_validation.cif.gz | 21.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37853 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37853 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37853 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-37853 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_37853.map.gz / 形式: CCP4 / 大きさ: 476.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_37853.map.gz / 形式: CCP4 / 大きさ: 476.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.84 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_37853_msk_1.map emd_37853_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
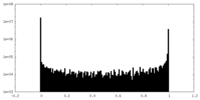
| 投影像・断面図 |
| ||||||||||||
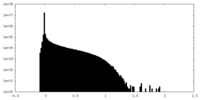
| 密度ヒストグラム |
-追加マップ: Output sharpened map by NU-refinement of cryoSPARC
| ファイル | emd_37853_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Output sharpened map by NU-refinement of cryoSPARC | ||||||||||||
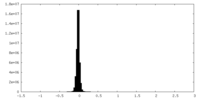
| 投影像・断面図 |
| ||||||||||||
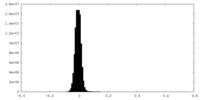
| 密度ヒストグラム |
-追加マップ: Map sharpened using deepEMhancer
| ファイル | emd_37853_additional_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Map sharpened using deepEMhancer | ||||||||||||
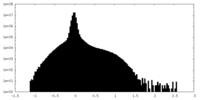
| 投影像・断面図 |
| ||||||||||||
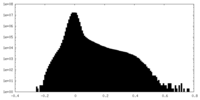
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_37853_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
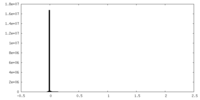
| 投影像・断面図 |
| ||||||||||||
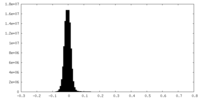
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_37853_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : H. thermoluteolus GroEL-GroES2 football complex bound with ADP-Mg2+
| 全体 | 名称: H. thermoluteolus GroEL-GroES2 football complex bound with ADP-Mg2+ |
|---|---|
| 要素 |
|
-超分子 #1: H. thermoluteolus GroEL-GroES2 football complex bound with ADP-Mg2+
| 超分子 | 名称: H. thermoluteolus GroEL-GroES2 football complex bound with ADP-Mg2+ タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 詳細: 6.76 mg/mL native GroEL was mixed with 3.7 mg/mL recombinant GroES followed by addition of 2 mM ATP in imaging buffer supplemented by detergents (0.1% 3-((3-cholamidopropyl) dimethylammonio)- ...詳細: 6.76 mg/mL native GroEL was mixed with 3.7 mg/mL recombinant GroES followed by addition of 2 mM ATP in imaging buffer supplemented by detergents (0.1% 3-((3-cholamidopropyl) dimethylammonio)-1-propanesulfonate (CHAPS), 0.05% n-Octyl-beta-D-glucopyranoside) |
|---|---|
| 由来(天然) | 生物種:  Hydrogenophilus thermoluteolus (バクテリア) / 株: TH-1 Hydrogenophilus thermoluteolus (バクテリア) / 株: TH-1 |
| 分子量 | 理論値: 73 kDa/nm |
-超分子 #2: H. thermoluteolus GroEL
| 超分子 | 名称: H. thermoluteolus GroEL / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1 |
|---|
-超分子 #3: H. thermoluteolus GroES
| 超分子 | 名称: H. thermoluteolus GroES / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #2 |
|---|
-分子 #1: Chaperonin GroEL
| 分子 | 名称: Chaperonin GroEL / タイプ: protein_or_peptide / ID: 1 / コピー数: 14 / 光学異性体: LEVO / EC番号: chaperonin ATPase |
|---|---|
| 由来(天然) | 生物種:  Hydrogenophilus thermoluteolus (バクテリア) / 株: TH-1 Hydrogenophilus thermoluteolus (バクテリア) / 株: TH-1 |
| 分子量 | 理論値: 56.08134 KDa |
| 配列 | 文字列: AAKEVKFHDS ARERLVAGVN LLANAVKTTL GPKGRNVVIE RSFGAPIVTK DGVTVAKEIE LKDKFENMGA QMVKEVASKT ADVAGDGTT TATVLAQAIV REGMKYVAAG MNPMDLKRGI DKAVTAIVEE LKAISKPCST TKEIAQVGTI SANADSSIGE I IAQAMDKV ...文字列: AAKEVKFHDS ARERLVAGVN LLANAVKTTL GPKGRNVVIE RSFGAPIVTK DGVTVAKEIE LKDKFENMGA QMVKEVASKT ADVAGDGTT TATVLAQAIV REGMKYVAAG MNPMDLKRGI DKAVTAIVEE LKAISKPCST TKEIAQVGTI SANADSSIGE I IAQAMDKV GKEGVITVED GKSLENELEV VEGMQFDRGY LSPYFINNPD KQVAVLDNPY ILLHDKKISN IRDLLPVLEQ VA KAGRPLL IIAEDVEGEA LATLVVNNLR GILKTCAVKA PGFGDRRKAM LQDIAILTGG TVISEEVGLS LEKATLEDLG QAK RVEVAK EHTTIIDGAG DPAKIQARVK EIRVQIEEAT SDYDREKLQE RVAKLAGGVA VIKVGAATEV EMKEKKARVE DALH ATRAA VEEGIVPGGG VALLRAREAA VAKGLKGDNP DQEAGIKIVL RAVEQPLREI VANAGEEPSV IVAKVLEGKG NYGYN AATG EFGDMIEMGV LDPTKVTRSA LQNAASVAGL MLTTECMIAE APKD UniProtKB: Chaperonin GroEL |
-分子 #2: Co-chaperonin GroES
| 分子 | 名称: Co-chaperonin GroES / タイプ: protein_or_peptide / ID: 2 / コピー数: 14 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Hydrogenophilus thermoluteolus (バクテリア) / 株: TH-1 Hydrogenophilus thermoluteolus (バクテリア) / 株: TH-1 |
| 分子量 | 理論値: 10.224831 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: KLRPLHDRVV VKRIEAERKT ASGIVIPDTA GEKPDQGEVL AVGDGKILDD GSKRPMAVKV GDKVLFGKYA GQTVKVEGEE LLVLREDDI MAVIE UniProtKB: Co-chaperonin GroES |
-分子 #3: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 14 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #4: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 4 / コピー数: 14 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 構成要素:
| |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| グリッド | モデル: Quantifoil R1.2/1.3 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: PLASMA CLEANING / 前処理 - 時間: 20 sec. / 前処理 - 雰囲気: OTHER / 詳細: Grids were freshly treated using Gatan Solarus II | |||||||||||||||||||||
| 凍結 | 凍結剤: ETHANE-PROPANE / チャンバー内湿度: 100 % / チャンバー内温度: 281 K / 装置: FEI VITROBOT MARK IV / 詳細: Blot force 0, blot time 8 s. |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 撮影 | フィルム・検出器のモデル: FEI FALCON IV (4k x 4k) 撮影したグリッド数: 1 / 実像数: 1233 / 平均露光時間: 4.95 sec. / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.0 µm / 倍率(公称値): 120000 |
| 試料ステージ | ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー













 Z
Z Y
Y X
X