+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Outward-facing structure of human ABCB6 W546A mutant (ADP/VO4-bound) | ||||||||||||
 マップデータ マップデータ | |||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | ATP-Binding Cassette transporter / mitochondrial transporter / outward-facing state / ADP/VO4-bound / ABCB6 / MEMBRANE PROTEIN / TRANSPORT PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報cellular detoxification of cadmium ion / Defective ABCB6 causes MCOPCB7 / Mitochondrial ABC transporters / tetrapyrrole metabolic process / heme transmembrane transport / ABC-type heme transporter / ABC-type heme transporter activity / porphyrin-containing compound metabolic process / heme transport / tetrapyrrole binding ...cellular detoxification of cadmium ion / Defective ABCB6 causes MCOPCB7 / Mitochondrial ABC transporters / tetrapyrrole metabolic process / heme transmembrane transport / ABC-type heme transporter / ABC-type heme transporter activity / porphyrin-containing compound metabolic process / heme transport / tetrapyrrole binding / heme metabolic process / porphyrin-containing compound biosynthetic process / melanosome assembly / melanosome membrane / multivesicular body membrane / mitochondrial envelope / endolysosome membrane / vacuolar membrane / skin development / efflux transmembrane transporter activity / intracellular copper ion homeostasis / ABC-type transporter activity / ATP-binding cassette (ABC) transporter complex / brain development / transmembrane transport / early endosome membrane / intracellular iron ion homeostasis / mitochondrial outer membrane / endosome / lysosomal membrane / Golgi membrane / heme binding / endoplasmic reticulum membrane / Golgi apparatus / endoplasmic reticulum / ATP hydrolysis activity / mitochondrion / extracellular exosome / nucleoplasm / ATP binding / plasma membrane / cytosol 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
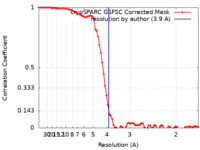
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.9 Å | ||||||||||||
 データ登録者 データ登録者 | Jin MS / Lee SS / Park JG / Jang E / Choi SH / Kim S / Kim JW | ||||||||||||
| 資金援助 |  韓国, 3件 韓国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Commun Biol / 年: 2023 ジャーナル: Commun Biol / 年: 2023タイトル: W546 stacking disruption traps the human porphyrin transporter ABCB6 in an outward-facing transient state. 著者: Sang Soo Lee / Jun Gyou Park / Eunhong Jang / Seung Hun Choi / Subin Kim / Ji Won Kim / Mi Sun Jin /  要旨: Human ATP-binding cassette transporter subfamily B6 (ABCB6) is a mitochondrial ATP-driven pump that translocates porphyrins from the cytoplasm into mitochondria for heme biosynthesis. Within the ...Human ATP-binding cassette transporter subfamily B6 (ABCB6) is a mitochondrial ATP-driven pump that translocates porphyrins from the cytoplasm into mitochondria for heme biosynthesis. Within the transport pathway, a conserved aromatic residue W546 located in each monomer plays a pivotal role in stabilizing the occluded conformation via π-stacking interactions. Herein, we employed cryo-electron microscopy to investigate the structural consequences of a single W546A mutation in ABCB6, both in detergent micelles and nanodiscs. The results demonstrate that the W546A mutation alters the conformational dynamics of detergent-purified ABCB6, leading to entrapment of the transporter in an outward-facing transient state. However, in the nanodisc system, we observed a direct interaction between the transporter and a phospholipid molecule that compensates for the absence of the W546 residue, thereby facilitating the normal conformational transition of the transporter toward the occluded state following ATP hydrolysis. The findings also reveal that adoption of the outward-facing conformation causes charge repulsion between ABCB6 and the bound substrate, and rearrangement of key interacting residues at the substrate-binding site. Consequently, the affinity for the substrate is significantly reduced, facilitating its release from the transporter. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_36938.map.gz emd_36938.map.gz | 43.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-36938-v30.xml emd-36938-v30.xml emd-36938.xml emd-36938.xml | 15.4 KB 15.4 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_36938_fsc.xml emd_36938_fsc.xml | 7.7 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_36938.png emd_36938.png | 20.5 KB | ||
| Filedesc metadata |  emd-36938.cif.gz emd-36938.cif.gz | 5.7 KB | ||
| その他 |  emd_36938_half_map_1.map.gz emd_36938_half_map_1.map.gz emd_36938_half_map_2.map.gz emd_36938_half_map_2.map.gz | 43.1 MB 43.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-36938 http://ftp.pdbj.org/pub/emdb/structures/EMD-36938 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-36938 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-36938 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_36938_validation.pdf.gz emd_36938_validation.pdf.gz | 1.2 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_36938_full_validation.pdf.gz emd_36938_full_validation.pdf.gz | 1.2 MB | 表示 | |
| XML形式データ |  emd_36938_validation.xml.gz emd_36938_validation.xml.gz | 15.6 KB | 表示 | |
| CIF形式データ |  emd_36938_validation.cif.gz emd_36938_validation.cif.gz | 19.9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-36938 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-36938 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-36938 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-36938 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8k7cMC  8k7bC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_36938.map.gz / 形式: CCP4 / 大きさ: 46.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_36938.map.gz / 形式: CCP4 / 大きさ: 46.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.851 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #2
| ファイル | emd_36938_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
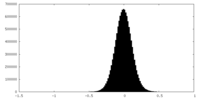
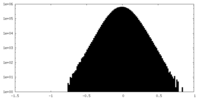
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_36938_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
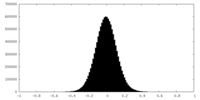
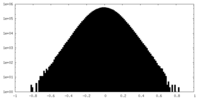
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : ATP-binding cassette sub-family B member 6 - Homo sapiens
| 全体 | 名称: ATP-binding cassette sub-family B member 6 - Homo sapiens |
|---|---|
| 要素 |
|
-超分子 #1: ATP-binding cassette sub-family B member 6 - Homo sapiens
| 超分子 | 名称: ATP-binding cassette sub-family B member 6 - Homo sapiens タイプ: organelle_or_cellular_component / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: ATP-binding cassette sub-family B member 6
| 分子 | 名称: ATP-binding cassette sub-family B member 6 / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO / EC番号: ABC-type heme transporter |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 65.869797 KDa |
| 組換発現 | 生物種:  Trichoplusia ni (イラクサキンウワバ) Trichoplusia ni (イラクサキンウワバ) |
| 配列 | 文字列: RDFGRKLRLL SGYLWPRGSP ALQLVVLICL GLMGLERALN VLVPIFYRNI VNLLTEKAPW NSLAWTVTSY VFLKFLQGGG TGSTGFVSN LRTFLWIRVQ QFTSRRVELL IFSHLHELSL RWHLGRRTGE VLRIADRGTS SVTGLLSYLV FNVIPTLADI I IGIIYFSM ...文字列: RDFGRKLRLL SGYLWPRGSP ALQLVVLICL GLMGLERALN VLVPIFYRNI VNLLTEKAPW NSLAWTVTSY VFLKFLQGGG TGSTGFVSN LRTFLWIRVQ QFTSRRVELL IFSHLHELSL RWHLGRRTGE VLRIADRGTS SVTGLLSYLV FNVIPTLADI I IGIIYFSM FFNAWFGLIV FLCMSLYLTL TIVVTEWRTK FRRAMNTQEN ATRARAVDSL LNFETVKYYN AESYEVERYR EA IIKYQGL EWKSSASLVL LNQTQNLVIG LGLLAGSLLC AYFVTEQKLQ VGDYVLFGTY IIQLYMPLNA FGTYYRMIQT NFI DMENMF DLLKEETEVK DLPGAGPLRF QKGRIEFENV HFSYADGRET LQDVSFTVMP GQTLALVGPS GAGKSTILRL LFRF YDISS GCIRIDGQDI SQVTQASLRS HIGVVPQDTV LFNDTIADNI RYGRVTAGND EVEAAAQAAG IHDAIMAFPE GYRTQ VGER GLKLSGGEKQ RVAIARTILK APGIILLDEA TSALDTSNER AIQASLAKVC ANRTTIVVAH RLSTVVNADQ ILVIKD GCI VERGRHEALL SRGGVYADMW QLQQ UniProtKB: ATP-binding cassette sub-family B member 6 |
-分子 #2: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 2 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #3: VANADATE ION
| 分子 | 名称: VANADATE ION / タイプ: ligand / ID: 3 / コピー数: 2 / 式: VO4 |
|---|---|
| 分子量 | 理論値: 114.939 Da |
| Chemical component information |  ChemComp-VN3: |
-分子 #4: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 4 / コピー数: 2 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 4 mg/mL |
|---|---|
| 緩衝液 | pH: 7 |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 277 K |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: SPOT SCAN / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.4 µm 最小 デフォーカス(公称値): 0.7000000000000001 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー







 Z
Z Y
Y X
X