+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Protein 110 and Q complex | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | GPCR / MEMBRANE PROTEIN | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報energy reserve metabolic process / fat cell differentiation / regulation of lipid metabolic process / synapse assembly / G protein-coupled receptor activity / adenylate cyclase-activating G protein-coupled receptor signaling pathway / Olfactory Signaling Pathway / Activation of the phototransduction cascade / G beta:gamma signalling through PLC beta / Presynaptic function of Kainate receptors ...energy reserve metabolic process / fat cell differentiation / regulation of lipid metabolic process / synapse assembly / G protein-coupled receptor activity / adenylate cyclase-activating G protein-coupled receptor signaling pathway / Olfactory Signaling Pathway / Activation of the phototransduction cascade / G beta:gamma signalling through PLC beta / Presynaptic function of Kainate receptors / Thromboxane signalling through TP receptor / G protein-coupled acetylcholine receptor signaling pathway / G-protein activation / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / memory / Prostacyclin signalling through prostacyclin receptor / Glucagon signaling in metabolic regulation / G beta:gamma signalling through CDC42 / G beta:gamma signalling through BTK / ADP signalling through P2Y purinoceptor 12 / Sensory perception of sweet, bitter, and umami (glutamate) taste / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / photoreceptor disc membrane / Glucagon-type ligand receptors / Adrenaline,noradrenaline inhibits insulin secretion / Vasopressin regulates renal water homeostasis via Aquaporins / G alpha (z) signalling events / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / cellular response to catecholamine stimulus / ADORA2B mediated anti-inflammatory cytokines production / sensory perception of taste / ADP signalling through P2Y purinoceptor 1 / G beta:gamma signalling through PI3Kgamma / adenylate cyclase-activating dopamine receptor signaling pathway / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / GPER1 signaling / cellular response to prostaglandin E stimulus / neuron projection development / Inactivation, recovery and regulation of the phototransduction cascade / G-protein beta-subunit binding / heterotrimeric G-protein complex / G alpha (12/13) signalling events / extracellular vesicle / signaling receptor complex adaptor activity / Thrombin signalling through proteinase activated receptors (PARs) / GTPase binding / retina development in camera-type eye / Ca2+ pathway / phospholipase C-activating G protein-coupled receptor signaling pathway / G alpha (i) signalling events / fibroblast proliferation / cytoplasmic vesicle / G alpha (s) signalling events / G alpha (q) signalling events / Ras protein signal transduction / cell population proliferation / Extra-nuclear estrogen signaling / cell surface receptor signaling pathway / G protein-coupled receptor signaling pathway / lysosomal membrane / GTPase activity / synapse / protein-containing complex binding / signal transduction / extracellular exosome / extracellular region / membrane / plasma membrane / cytosol / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | |||||||||
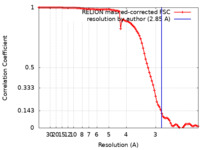
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.85 Å | |||||||||
 データ登録者 データ登録者 | He Y / Zhu X | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Structural basis of adhesion GPCR GPR110 activation by stalk peptide and G-proteins coupling. 著者: Xinyan Zhu / Yu Qian / Xiaowan Li / Zhenmei Xu / Ruixue Xia / Na Wang / Jiale Liang / Han Yin / Anqi Zhang / Changyou Guo / Guangfu Wang / Yuanzheng He /  要旨: Adhesion G protein-coupled receptors (aGPCRs) are keys of many physiological events and attractive targets for various diseases. aGPCRs are also known to be capable of self-activation via an ...Adhesion G protein-coupled receptors (aGPCRs) are keys of many physiological events and attractive targets for various diseases. aGPCRs are also known to be capable of self-activation via an autoproteolysis process that removes the inhibitory GAIN domain on the extracellular side of receptor and releases a stalk peptide to bind and activate the transmembrane side of receptor. However, the detailed mechanism of aGPCR activation remains elusive. Here, we report the cryo-electron microscopy structures of GPR110 (ADGRF1), a member of aGPCR, in complex with G, G, G, G and G The structures reveal distinctive ligand engaging model and activation conformations of GPR110. The structures also unveil the rarely explored GPCR/G and GPCR/G engagements. A comparison of G, G, G, G and G engagements with GPR110 reveals details of G-protein engagement, including a dividing point at the far end of the alpha helix 5 (αH5) of Gα subunit that separates G/G engagements from G/G/G engagements. This is also where G/G bind the receptor through both hydrophobic and polar interaction, while G/G/G engage receptor mainly through hydrophobic interaction. We further provide physiological evidence of GPR110 activation via stalk peptide. Taken together, our study fills the missing information of GPCR/G-protein engagement and provides a framework for understanding aGPCR activation and GPR110 signaling. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_32881.map.gz emd_32881.map.gz | 55.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-32881-v30.xml emd-32881-v30.xml emd-32881.xml emd-32881.xml | 17.9 KB 17.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_32881_fsc.xml emd_32881_fsc.xml | 9.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_32881.png emd_32881.png | 74.1 KB | ||
| Filedesc metadata |  emd-32881.cif.gz emd-32881.cif.gz | 6.9 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-32881 http://ftp.pdbj.org/pub/emdb/structures/EMD-32881 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-32881 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-32881 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_32881_validation.pdf.gz emd_32881_validation.pdf.gz | 393.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_32881_full_validation.pdf.gz emd_32881_full_validation.pdf.gz | 393.4 KB | 表示 | |
| XML形式データ |  emd_32881_validation.xml.gz emd_32881_validation.xml.gz | 10.8 KB | 表示 | |
| CIF形式データ |  emd_32881_validation.cif.gz emd_32881_validation.cif.gz | 14.3 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32881 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32881 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32881 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32881 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_32881.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_32881.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.1 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : GPCR/G-protein complex
| 全体 | 名称: GPCR/G-protein complex |
|---|---|
| 要素 |
|
-超分子 #1: GPCR/G-protein complex
| 超分子 | 名称: GPCR/G-protein complex / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-超分子 #2: GPCR/G-protein
| 超分子 | 名称: GPCR/G-protein / タイプ: complex / ID: 2 / 親要素: 1 / 含まれる分子: #1-#3, #5 |
|---|---|
| 由来(天然) | 生物種:  |
-超分子 #3: NB35
| 超分子 | 名称: NB35 / タイプ: complex / ID: 3 / 親要素: 1 / 含まれる分子: #4 |
|---|
-分子 #1: engineered mini Galpha-Q subunit
| 分子 | 名称: engineered mini Galpha-Q subunit / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 41.855578 KDa |
| 組換発現 | 生物種:  Insect BA phytoplasma (バクテリア) Insect BA phytoplasma (バクテリア) |
| 配列 | 文字列: MMGCTLSAED KAAVERSKMI EKQLQKDKQV YRRTLRLLLL GADNSGKSTI VKQMRIYHVN GYSEEECKQY KAVVYSNTIQ SIIAIIRAM GRLKIDFGDS ARADDARQLF VLAGAAEEGF MTAELAGVIK RLWKDSGVQA CFNRSREYQL NDSAAYYLND L DRIAQPNY ...文字列: MMGCTLSAED KAAVERSKMI EKQLQKDKQV YRRTLRLLLL GADNSGKSTI VKQMRIYHVN GYSEEECKQY KAVVYSNTIQ SIIAIIRAM GRLKIDFGDS ARADDARQLF VLAGAAEEGF MTAELAGVIK RLWKDSGVQA CFNRSREYQL NDSAAYYLND L DRIAQPNY IPTQQDVLRT RVKTSGIFET KFQVDKVNFH MFDVGAQRDE RRKWIQCFND VTAIIFVVDS SDYNRLQEAL ND FKSIWNN RWLRTISVIL FLNKQDLLAE KVLAGKSKIE DYFPEFARYT TPEDATPEPG EDPRVTRAKY FIRKEFVDIS TAS GDGRHI CYPHFTCSVD TENARRIFND CKDIILQMNL REYNLV |
-分子 #2: Guanine nucleotide-binding protein G(I)/G(S)/G(T) subunit beta-1
| 分子 | 名称: Guanine nucleotide-binding protein G(I)/G(S)/G(T) subunit beta-1 タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 37.915496 KDa |
| 組換発現 | 生物種:  Insect BA phytoplasma (バクテリア) Insect BA phytoplasma (バクテリア) |
| 配列 | 文字列: MGSLLQSELD QLRQEAEQLK NQIRDARKAC ADATLSQITN NIDPVGRIQM RTRRTLRGHL AKIYAMHWGT DSRLLVSASQ DGKLIIWDS YTTNKVHAIP LRSSWVMTCA YAPSGNYVAC GGLDNICSIY NLKTREGNVR VSRELAGHTG YLSCCRFLDD N QIVTSSGD ...文字列: MGSLLQSELD QLRQEAEQLK NQIRDARKAC ADATLSQITN NIDPVGRIQM RTRRTLRGHL AKIYAMHWGT DSRLLVSASQ DGKLIIWDS YTTNKVHAIP LRSSWVMTCA YAPSGNYVAC GGLDNICSIY NLKTREGNVR VSRELAGHTG YLSCCRFLDD N QIVTSSGD TTCALWDIET GQQTTTFTGH TGDVMSLSLA PDTRLFVSGA CDASAKLWDV REGMCRQTFT GHESDINAIC FF PNGNAFA TGSDDATCRL FDLRADQELM TYSHDNIICG ITSVSFSKSG RLLLAGYDDF NCNVWDALKA DRAGVLAGHD NRV SCLGVT DDGMAVATGS WDSFLKIWN UniProtKB: Guanine nucleotide-binding protein G(I)/G(S)/G(T) subunit beta-1 |
-分子 #3: Guanine nucleotide-binding protein G(I)/G(S)/G(O) subunit gamma-2
| 分子 | 名称: Guanine nucleotide-binding protein G(I)/G(S)/G(O) subunit gamma-2 タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 7.861143 KDa |
| 組換発現 | 生物種:  Insect BA phytoplasma (バクテリア) Insect BA phytoplasma (バクテリア) |
| 配列 | 文字列: MASNNTASIA QARKLVEQLK MEANIDRIKV SKAAADLMAY CEAHAKEDPL LTPVPASENP FREKKFFCAI L UniProtKB: Guanine nucleotide-binding protein G(I)/G(S)/G(O) subunit gamma-2 |
-分子 #4: NB35
| 分子 | 名称: NB35 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 17.381584 KDa |
| 組換発現 | 生物種:  Bacteria abnormis (昆虫) Bacteria abnormis (昆虫) |
| 配列 | 文字列: MKYLLPTAAA GLLLLAAQPA MAQVQLQESG GGLVQPGGSL RLSCAASGFT FSNYKMNWVR QAPGKGLEWV SDISQSGASI SYTGSVKGR FTISRDNAKN TLYLQMNSLK PEDTAVYYCA RCPAPFTRDC FDVTSTTYAY RGQGTQVTVS SAAALEHHHH H H |
-分子 #5: Adhesion G-protein coupled receptor F1
| 分子 | 名称: Adhesion G-protein coupled receptor F1 / タイプ: protein_or_peptide / ID: 5 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 101.465219 KDa |
| 組換発現 | 生物種:  Insect BA phytoplasma (バクテリア) Insect BA phytoplasma (バクテリア) |
| 配列 | 文字列: MKVGVLWLIS FFTFTDGHGG FLGKNDGIKT KKELIVNKKK HLGPVEEYQL LLQVTYRDSK EKRDLRNFLK LLKPPLLWSH GLIRIIRAK ATTDCNSLNG VLQCTCEDSY TWFPPSCLDP QNCYLHTAGA LPSCECHLNN LSQSVNFCER TKIWGTFKIN E RFTNDLLN ...文字列: MKVGVLWLIS FFTFTDGHGG FLGKNDGIKT KKELIVNKKK HLGPVEEYQL LLQVTYRDSK EKRDLRNFLK LLKPPLLWSH GLIRIIRAK ATTDCNSLNG VLQCTCEDSY TWFPPSCLDP QNCYLHTAGA LPSCECHLNN LSQSVNFCER TKIWGTFKIN E RFTNDLLN SSSAIYSKYA NGIEIQLKKA YERIQGFESV QVTQFRNGSI VAGYEVVGSS SASELLSAIE HVAEKAKTAL HK LFPLEDG SFRVFGKAQC NDIVFGFGSK DDEYTLPCSS GYRGNITAKC ESSGWQVIRE TCVLSLLEEL NKNFSMIVGN ATE AAVSSF VQNLSVIIRQ NPSTTVGNLA SVVSILSNIS SLSLASHFRV SNSTMEDVIS IADNILNSAS VTNWTVLLRE EKYA SSRLL ETLENISTLV PPTALPLNFS RKFIDWKGIP VNKSQLKRGY SYQIKMCPQN TSIPIRGRVL IGSDQFQRSL PETII SMAS LTLGNILPVS KNGNAQVNGP VISTVIQNYS INEVFLFFSK IESNLSQPHC VFWDFSHLQW NDAGCHLVNE TQDIVT CQC THLTSFSILM SPFVPSTIFP VVKWITYVGL GISIGSLILC LIIEALFWKQ IKKSQTSHTR RICMVNIALS LLIADVW FI VGATVDTTVN PSGVCTAAVF FTHFFYLSLF FWMLMLGILL AYRIILVFHH MAQHLMMAVG FCLGYGCPLI ISVITIAV T QPSNTYKRKD VCWLNWSNGS KPLLAFVVPA LAIVAVNFVV VLLVLTKLWR PTVGERLSRD DKATIIRVGK SLLILTPLL GLTWGFGIGT IVDSQNLAWH VIFALLNAFQ GFFILCFGIL LDSKLRQLLF NKLSALSSWK QTEKQNSSDL SAKPKFSKPF NPLQNKGHY AFSHTGDSSD NIMLTQFVSN E UniProtKB: Adhesion G-protein coupled receptor F1 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | 3D array |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: BRIGHT FIELD 最大 デフォーカス(公称値): 2.3000000000000003 µm 最小 デフォーカス(公称値): 1.2 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー






























 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)