+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | PC-(acetyl-CoA)(50 uM) | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.4 Å | |||||||||
 データ登録者 データ登録者 | Chai P / Lan P / Wu J / Lei M | |||||||||
| 資金援助 |  中国, 1件 中国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Mol Cell / 年: 2022 ジャーナル: Mol Cell / 年: 2022タイトル: Mechanistic insight into allosteric activation of human pyruvate carboxylase by acetyl-CoA. 著者: Peiwei Chai / Pengfei Lan / Shaobai Li / Deqiang Yao / Chenchen Chang / Mi Cao / Yafeng Shen / Shengfang Ge / Jian Wu / Ming Lei / Xianqun Fan /  要旨: Pyruvate carboxylase (PC) catalyzes the two-step carboxylation of pyruvate to produce oxaloacetate, playing a key role in the maintenance of metabolic homeostasis in cells. Given its involvement in ...Pyruvate carboxylase (PC) catalyzes the two-step carboxylation of pyruvate to produce oxaloacetate, playing a key role in the maintenance of metabolic homeostasis in cells. Given its involvement in multiple diseases, PC has been regarded as a potential therapeutic target for obesity, diabetes, and cancer. Albeit acetyl-CoA has been recognized as the allosteric regulator of PC for over 60 years, the underlying mechanism of how acetyl-CoA induces PC activation remains enigmatic. Herein, by using time-resolved cryo-electron microscopy, we have captured the snapshots of PC transitional states during its catalytic cycle. These structures and the biochemical studies reveal that acetyl-CoA stabilizes PC in a catalytically competent conformation, which triggers a cascade of events, including ATP hydrolysis and the long-distance communication between the two reactive centers. These findings provide an integrated picture for PC catalysis and unveil the unique allosteric mechanism of acetyl-CoA in an essential biochemical reaction in all kingdoms of life. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_32776.map.gz emd_32776.map.gz | 85.4 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-32776-v30.xml emd-32776-v30.xml emd-32776.xml emd-32776.xml | 9.7 KB 9.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_32776.png emd_32776.png | 101.5 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-32776 http://ftp.pdbj.org/pub/emdb/structures/EMD-32776 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-32776 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-32776 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_32776_validation.pdf.gz emd_32776_validation.pdf.gz | 459.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_32776_full_validation.pdf.gz emd_32776_full_validation.pdf.gz | 459.5 KB | 表示 | |
| XML形式データ |  emd_32776_validation.xml.gz emd_32776_validation.xml.gz | 6.3 KB | 表示 | |
| CIF形式データ |  emd_32776_validation.cif.gz emd_32776_validation.cif.gz | 7.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32776 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32776 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32776 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-32776 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_32776.map.gz / 形式: CCP4 / 大きさ: 91.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_32776.map.gz / 形式: CCP4 / 大きさ: 91.1 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.1 Å | ||||||||||||||||||||||||||||||||||||
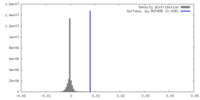
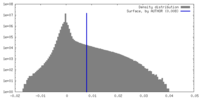
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : PC
| 全体 | 名称: PC |
|---|---|
| 要素 |
|
-超分子 #1: PC
| 超分子 | 名称: PC / タイプ: complex / キメラ: Yes / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: pyruvate carboxylase
| 分子 | 名称: pyruvate carboxylase / タイプ: protein_or_peptide / ID: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MLKFRTVHGG LRLLGIRRTS TAPAASPNVR RLEYKPIKKV MVANRGEIAI RVFRACTELG IRTVAIYSEQ DTGQMHRQK ADEAYLIGRG LAPVQAYLHI PDIIKVAKEN NVDAVHPGYG FLSERADFAQ ACQDAGVRFI G PSPEVVRK MGDKVEARAI AIAAGVPVVP ...文字列: MLKFRTVHGG LRLLGIRRTS TAPAASPNVR RLEYKPIKKV MVANRGEIAI RVFRACTELG IRTVAIYSEQ DTGQMHRQK ADEAYLIGRG LAPVQAYLHI PDIIKVAKEN NVDAVHPGYG FLSERADFAQ ACQDAGVRFI G PSPEVVRK MGDKVEARAI AIAAGVPVVP GTDAPITSLH EAHEFSNTYG FPIIFKAAYG GGGRGMRVVH SY EELEENY TRAYSEALAA FGNGALFVEK FIEKPRHIEV QILGDQYGNI LHLYERDCSI QRRHQKVVEI APA AHLDPQ LRTRLTSDSV KLAKQVGYEN AGTVEFLVDR HGKHYFIEVN SRLQVEHTVT EEITDVDLVH AQIH VAEGR SLPDLGLRQE NIRINGCAIQ CRVTTEDPAR SFQPDTGRIE VFRSGEGMGI RLDNASAFQG AVISP HYDS LLVKVIAHGK DHPTAATKMS RALAEFRVRG VKTNIAFLQN VLNNQQFLAG TVDTQFIDEN PELFQL RPA QNRAQKLLHY LGHVMVNGPT TPIPVKASPS PTDPVVPAVP IGPPPAGFRD ILLREGPEGF ARAVRNH PG LLLMDTTFRD AHQSLLATRV RTHDLKKIAP YVAHNFSKLF SMENWGGATF DVAMRFLYEC PWRRLQEL R ELIPNIPFQM LLRGANAVGY TNYPDNVVFK FCEVAKENGM DVFRVFDSLN YLPNMLLGME AAGSAGGVV EAAISYTGDV ADPSRTKYSL QYYMGLAEEL VRAGTHILCI KDMAGLLKPT ACTMLVSSLR DRFPDLPLHI HTHDTSGAG VAAMLACAQA GADVVDVAAD SMSGMTSQPS MGALVACTRG TPLDTEVPME RVFDYSEYWE G ARGLYAAF DCTATMKSGN SDVYENEIPG GQYTNLHFQA HSMGLGSKFK EVKKAYVEAN QMLGDLIKVT PS SKIVGDL AQFMVQNGLS RAEAEAQAEE LSFPRSVVEF LQGYIGVPHG GFPEPFRSKV LKDLPRVEGR PGA SLPPLD LQALEKELVD RHGEEVTPED VLSAAMYPDV FAHFKDFTAT FGPLDSLNTR LFLQGPKIAE EFEV ELERG KTLHIKALAV SDLNRAGQRQ VFFELNGQLR SILVKDTQAM KEMHFHPKAL KDVKGQIGAP MPGKV IDIK VVAGAKVAKG QPLCVLSAMK METVVTSPME GTVRKVHVTK DMTLEGDDLI LEIE |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 8 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 平均電子線量: 40.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.5 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: PDB ENTRY PDBモデル - PDB ID: |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 147831 |
| 初期 角度割当 | タイプ: COMMON LINE |
| 最終 角度割当 | タイプ: MAXIMUM LIKELIHOOD |
 ムービー
ムービー コントローラー
コントローラー



















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)