+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-3271 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Importin-beta can bind Hepatitis B Virus core protein and empty core-like particles and induce structural changes | |||||||||
 マップデータ マップデータ | Cryo-EM reconstruction of unphosphorylated Cp183 and Imp-beta in NaCl | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | HBV / Cp183 / Importin-beta | |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /   Hepatitis B virus (B 型肝炎ウイルス) Hepatitis B virus (B 型肝炎ウイルス) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 8.9 Å | |||||||||
 データ登録者 データ登録者 | Chen C / Wang JC-Y / Pierson EE / Kiefer DZ / Delaleau M / Gallucci L / Cazenave C / Kann M / Jarrold MF / Zlotnick A | |||||||||
 引用 引用 |  ジャーナル: PLoS Pathog / 年: 2016 ジャーナル: PLoS Pathog / 年: 2016タイトル: Importin β Can Bind Hepatitis B Virus Core Protein and Empty Core-Like Particles and Induce Structural Changes. 著者: Chao Chen / Joseph Che-Yen Wang / Elizabeth E Pierson / David Z Keifer / Mildred Delaleau / Lara Gallucci / Christian Cazenave / Michael Kann / Martin F Jarrold / Adam Zlotnick /   要旨: Hepatitis B virus (HBV) capsids are found in many forms: immature single-stranded RNA-filled cores, single-stranded DNA-filled replication intermediates, mature cores with relaxed circular double- ...Hepatitis B virus (HBV) capsids are found in many forms: immature single-stranded RNA-filled cores, single-stranded DNA-filled replication intermediates, mature cores with relaxed circular double-stranded DNA, and empty capsids. A capsid, the protein shell of the core, is a complex of 240 copies of core protein. Mature cores are transported to the nucleus by a complex that includes both importin α and importin β (Impα and Impβ), which bind to the core protein's C-terminal domains (CTDs). Here we have investigated the interactions of HBV core protein with importins in vitro. Strikingly, empty capsids and free core protein can bind Impβ without Impα. Cryo-EM image reconstructions show that the CTDs, which are located inside the capsid, can extrude through the capsid to be bound by Impβ. Impβ density localized on the capsid exterior near the quasi-sixfold vertices, suggested a maximum of 30 Impβ per capsid. However, examination of complexes using single molecule charge-detection mass spectrometry indicate that some complexes include over 90 Impβ molecules. Cryo-EM of capsids incubated with excess Impβ shows a population of damaged particles and a population of "dark" particles with internal density, suggesting that Impβ is effectively swallowed by the capsids, which implies that the capsids transiently open and close and can be destabilized by Impβ. Though the in vitro complexes with great excess of Impβ are not biological, these results have implications for trafficking of empty capsids and free core protein; activities that affect the basis of chronic HBV infection. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_3271.map.gz emd_3271.map.gz | 110.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-3271-v30.xml emd-3271-v30.xml emd-3271.xml emd-3271.xml | 10.7 KB 10.7 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_3271.png emd_3271.png | 205.7 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-3271 http://ftp.pdbj.org/pub/emdb/structures/EMD-3271 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3271 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-3271 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_3271_validation.pdf.gz emd_3271_validation.pdf.gz | 212.6 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_3271_full_validation.pdf.gz emd_3271_full_validation.pdf.gz | 211.7 KB | 表示 | |
| XML形式データ |  emd_3271_validation.xml.gz emd_3271_validation.xml.gz | 7.5 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3271 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3271 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3271 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-3271 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_3271.map.gz / 形式: CCP4 / 大きさ: 238.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_3271.map.gz / 形式: CCP4 / 大きさ: 238.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Cryo-EM reconstruction of unphosphorylated Cp183 and Imp-beta in NaCl | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.512 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
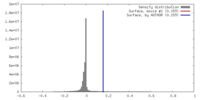
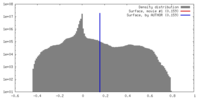
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : 11 uM Cp183 dimer in capsid form and 18.8 uM Imp-beta in NaCl
| 全体 | 名称: 11 uM Cp183 dimer in capsid form and 18.8 uM Imp-beta in NaCl |
|---|---|
| 要素 |
|
-超分子 #1000: 11 uM Cp183 dimer in capsid form and 18.8 uM Imp-beta in NaCl
| 超分子 | 名称: 11 uM Cp183 dimer in capsid form and 18.8 uM Imp-beta in NaCl タイプ: sample / ID: 1000 / Number unique components: 2 |
|---|
-超分子 #1: Hepatitis B virus
| 超分子 | 名称: Hepatitis B virus / タイプ: virus / ID: 1 / Name.synonym: HBV / NCBI-ID: 10407 / 生物種: Hepatitis B virus / Sci species strain: adyw / ウイルスタイプ: VIRUS-LIKE PARTICLE / ウイルス・単離状態: STRAIN / ウイルス・エンベロープ: No / ウイルス・中空状態: No / Syn species name: HBV |
|---|---|
| 宿主 | 生物種:  Homo sapiens (ヒト) / 別称: VERTEBRATES Homo sapiens (ヒト) / 別称: VERTEBRATES |
| Host system | 生物種:  |
| 分子量 | 実験値: 4.8 MDa / 理論値: 4.8 MDa |
| ウイルス殻 | Shell ID: 1 / 名称: Cp183 / T番号(三角分割数): 4 |
-分子 #1: importin beta
| 分子 | 名称: importin beta / タイプ: protein_or_peptide / ID: 1 / Name.synonym: Imp-beta / 組換発現: Yes |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 別称: Human Homo sapiens (ヒト) / 別称: Human |
| 組換発現 | 生物種:  |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 0.39 mg/mL |
|---|---|
| 緩衝液 | pH: 7.4 / 詳細: 0.15 M ammonium formate |
| グリッド | 詳細: glow-discharged holey carbon grid (Quantifoil R2/2) or continuous carbon film coated grid (EMS) |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 98 K / 装置: FEI VITROBOT MARK III / 手法: Blot for 4 seconds before plunging |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | JEOL 3200FS |
|---|---|
| 温度 | 平均: 98 K |
| 特殊光学系 | エネルギーフィルター - 名称: Omega filter エネルギーフィルター - エネルギー下限: 0.0 eV エネルギーフィルター - エネルギー上限: 20.0 eV |
| 詳細 | Weak beam illumination |
| 日付 | 2014年5月25日 |
| 撮影 | カテゴリ: CCD フィルム・検出器のモデル: GATAN ULTRASCAN 4000 (4k x 4k) デジタル化 - サンプリング間隔: 15 µm / 実像数: 109 / 平均電子線量: 25 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 1.1 mm / 最大 デフォーカス(公称値): 4.57 µm / 最小 デフォーカス(公称値): 0.91 µm / 倍率(公称値): 80000 |
| 試料ステージ | 試料ホルダー: Gatan 626 / 試料ホルダーモデル: GATAN LIQUID NITROGEN |
- 画像解析
画像解析
| 詳細 | Data processed by auto3dem |
|---|---|
| CTF補正 | 詳細: each particle |
| 最終 再構成 | 想定した対称性 - 点群: I (正20面体型対称) / 解像度のタイプ: BY AUTHOR / 解像度: 8.9 Å / 解像度の算出法: OTHER / ソフトウェア - 名称: Auto3dem / 使用した粒子像数: 6443 |
 ムービー
ムービー コントローラー
コントローラー
















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)