+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Focused refinement of V. radiata respiratory supercomplex I+III2 around complex I bridge | |||||||||
 マップデータ マップデータ | Focused refinement of bridged SC I III2 class 1 around complex I bridge | |||||||||
 試料 試料 |
| |||||||||
| 生物種 |  Vigna radiata (リョクトウ) Vigna radiata (リョクトウ) | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||
 データ登録者 データ登録者 | Maldonado M / Letts JA | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Plants / 年: 2023 ジャーナル: Nat Plants / 年: 2023タイトル: Plant-specific features of respiratory supercomplex I + III from Vigna radiata. 著者: M Maldonado / Z Fan / K M Abe / J A Letts /  要旨: The last steps of cellular respiration-an essential metabolic process in plants-are carried out by mitochondrial oxidative phosphorylation. This process involves a chain of multi-subunit membrane ...The last steps of cellular respiration-an essential metabolic process in plants-are carried out by mitochondrial oxidative phosphorylation. This process involves a chain of multi-subunit membrane protein complexes (complexes I-V) that form higher-order assemblies called supercomplexes. Although supercomplexes are the most physiologically relevant form of the oxidative phosphorylation complexes, their functions and structures remain mostly unknown. Here we present the cryogenic electron microscopy structure of the supercomplex I + III from Vigna radiata (mung bean). The structure contains the full subunit complement of complex I, including a newly assigned, plant-specific subunit. It also shows differences in the mitochondrial processing peptidase domain of complex III relative to a previously determined supercomplex with complex IV. The supercomplex interface, while reminiscent of that in other organisms, is plant specific, with a major interface involving complex III's mitochondrial processing peptidase domain and no participation of complex I's bridge domain. The complex I structure suggests that the bridge domain sets the angle between the enzyme's two arms, limiting large-scale conformational changes. Moreover, complex I's catalytic loops and its response in active-to-deactive assays suggest that, in V. radiata, the resting complex adopts a non-canonical state and can sample deactive- or open-like conformations even in the presence of substrate. This study widens our understanding of the possible conformations and behaviour of complex I and supercomplex I + III. Further studies of complex I and its supercomplexes in diverse organisms are needed to determine the universal and clade-specific mechanisms of respiration. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_29088.map.gz emd_29088.map.gz | 778.7 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-29088-v30.xml emd-29088-v30.xml emd-29088.xml emd-29088.xml | 21.1 KB 21.1 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_29088_fsc.xml emd_29088_fsc.xml | 19.9 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_29088.png emd_29088.png | 96 KB | ||
| マスクデータ |  emd_29088_msk_1.map emd_29088_msk_1.map | 824 MB |  マスクマップ マスクマップ | |
| その他 |  emd_29088_half_map_1.map.gz emd_29088_half_map_1.map.gz emd_29088_half_map_2.map.gz emd_29088_half_map_2.map.gz | 765.6 MB 765.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-29088 http://ftp.pdbj.org/pub/emdb/structures/EMD-29088 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29088 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29088 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_29088_validation.pdf.gz emd_29088_validation.pdf.gz | 1 MB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_29088_full_validation.pdf.gz emd_29088_full_validation.pdf.gz | 1 MB | 表示 | |
| XML形式データ |  emd_29088_validation.xml.gz emd_29088_validation.xml.gz | 29.5 KB | 表示 | |
| CIF形式データ |  emd_29088_validation.cif.gz emd_29088_validation.cif.gz | 38.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29088 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29088 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29088 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29088 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_29088.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_29088.map.gz / 形式: CCP4 / 大きさ: 824 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Focused refinement of bridged SC I III2 class 1 around complex I bridge | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.88 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-マスク #1
| ファイル |  emd_29088_msk_1.map emd_29088_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Focused refinement of bridged SC I III2 class...
| ファイル | emd_29088_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Focused refinement of bridged SC I III2 class 1 around complex I bridge half map A | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Focused refinement of bridged SC I III2 class...
| ファイル | emd_29088_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Focused refinement of bridged SC I III2 class 1 around complex I bridge half map B | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Vigna radiata supercomplex I+III2 (full bridge)
| 全体 | 名称: Vigna radiata supercomplex I+III2 (full bridge) |
|---|---|
| 要素 |
|
-超分子 #1: Vigna radiata supercomplex I+III2 (full bridge)
| 超分子 | 名称: Vigna radiata supercomplex I+III2 (full bridge) / タイプ: complex / ID: 1 / キメラ: Yes / 親要素: 0 / 含まれる分子: #1-#40, #42-#59 詳細: Higher-order assembly between respiratory complex I and complex III2 |
|---|---|
| 由来(天然) | 生物種:  Vigna radiata (リョクトウ) Vigna radiata (リョクトウ) |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 1.55 mg/mL |
|---|---|
| 緩衝液 | pH: 7.7 詳細: 0.2% digitonin, 30 mM HEPES pH 7.7, 150 mM potassium acetate, 1 mM EDTA, 0.002% PMSF |
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 90 % / 装置: LEICA EM GP / 詳細: 4 ul, 20 seconds pre-blot, blot 4 seconds. |
| 詳細 | Digitonin-extracted, amphipol (A8-35)stabilized |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS GLACIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 (6k x 4k) / 撮影したグリッド数: 2 / 実像数: 25712 / 平均露光時間: 3.0 sec. / 平均電子線量: 60.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: OTHER / 撮影モード: OTHER / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.5 µm |
| 試料ステージ | ホルダー冷却材: NITROGEN |
- 画像解析
画像解析
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / ソフトウェア - 名称: cryoSPARC / 使用した粒子像数: 123461 |
|---|---|
| 初期 角度割当 | タイプ: NOT APPLICABLE |
| 最終 角度割当 | タイプ: NOT APPLICABLE |
| FSC曲線 (解像度の算出) | 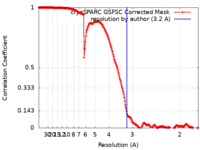 |
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
|---|
 ムービー
ムービー コントローラー
コントローラー


















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)