登録情報 データベース : EMDB / ID : EMD-29038タイトル Amyloid-beta (1-40) fibrils derived from familial Dutch-type CAA patient (population A) Map after auto-refinement. 複合体 : Fibrillar assembly of human Amyloid-beta 1-40 from a familial Dutch-type cerebral amyloid angiopathy patientタンパク質・ペプチド : Amyloid beta (1-40) / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
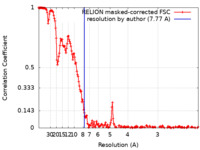
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / 解像度 : 7.77 Å Crooks EJ / Fu Z / Chowdury S / Steven OS 資金援助 Organization Grant number 国 National Institutes of Health/National Institute on Aging (NIH/NIA) AG061775 National Institutes of Health/National Institute on Aging (NIH/NIA) AG027317
ジャーナル : J Struct Biol / 年 : 2024タイトル : An electrostatic cluster guides Aβ40 fibril formation in sporadic and Dutch-type cerebral amyloid angiopathy.著者 : Ziao Fu / Elliot J Crooks / Brandon A Irizarry / Xiaoyue Zhu / Saikat Chowdhury / William E Van Nostrand / Steven O Smith / 要旨 : Cerebral amyloid angiopathy (CAA) is associated with the accumulation of fibrillar Aβ peptides upon and within the cerebral vasculature, which leads to loss of vascular integrity and contributes to ... Cerebral amyloid angiopathy (CAA) is associated with the accumulation of fibrillar Aβ peptides upon and within the cerebral vasculature, which leads to loss of vascular integrity and contributes to disease progression in Alzheimer's disease (AD). We investigate the structure of human-derived Aβ40 fibrils obtained from patients diagnosed with sporadic or familial Dutch-type (E22Q) CAA. Using cryo-EM, two primary structures are identified containing elements that have not been observed in in vitro Aβ40 fibril structures. One population has an ordered N-terminal fold comprised of two β-strands stabilized by electrostatic interactions involving D1, E22, D23 and K28. This charged cluster is disrupted in the second population, which exhibits a disordered N-terminus and is favored in fibrils derived from the familial Dutch-type CAA patient. These results illustrate differences between human-derived CAA and AD fibrils, and how familial CAA mutations can guide fibril formation. 履歴 登録 2022年12月7日 - ヘッダ(付随情報) 公開 2023年12月6日 - マップ公開 2023年12月6日 - 更新 2024年6月19日 - 現状 2024年6月19日 処理サイト : RCSB / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報
 マップデータ
マップデータ 試料
試料 キーワード
キーワード 機能・相同性情報
機能・相同性情報 Homo sapiens (ヒト)
Homo sapiens (ヒト) データ登録者
データ登録者 米国, 2件
米国, 2件  引用
引用 ジャーナル: J Struct Biol / 年: 2024
ジャーナル: J Struct Biol / 年: 2024

 構造の表示
構造の表示 ダウンロードとリンク
ダウンロードとリンク emd_29038.map.gz
emd_29038.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-29038-v30.xml
emd-29038-v30.xml emd-29038.xml
emd-29038.xml EMDBヘッダ
EMDBヘッダ emd_29038_fsc.xml
emd_29038_fsc.xml FSCデータファイル
FSCデータファイル emd_29038.png
emd_29038.png emd_29038_msk_1.map
emd_29038_msk_1.map マスクマップ
マスクマップ emd-29038.cif.gz
emd-29038.cif.gz emd_29038_half_map_1.map.gz
emd_29038_half_map_1.map.gz emd_29038_half_map_2.map.gz
emd_29038_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-29038
http://ftp.pdbj.org/pub/emdb/structures/EMD-29038 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29038
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-29038 emd_29038_validation.pdf.gz
emd_29038_validation.pdf.gz EMDB検証レポート
EMDB検証レポート emd_29038_full_validation.pdf.gz
emd_29038_full_validation.pdf.gz emd_29038_validation.xml.gz
emd_29038_validation.xml.gz emd_29038_validation.cif.gz
emd_29038_validation.cif.gz https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29038
https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29038 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29038
ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-29038 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_29038.map.gz / 形式: CCP4 / 大きさ: 476.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_29038.map.gz / 形式: CCP4 / 大きさ: 476.8 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) emd_29038_msk_1.map
emd_29038_msk_1.map 試料の構成要素
試料の構成要素 Homo sapiens (ヒト) / 器官: Brain / 組織: Vasculature
Homo sapiens (ヒト) / 器官: Brain / 組織: Vasculature Homo sapiens (ヒト)
Homo sapiens (ヒト) 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 画像解析
画像解析 ムービー
ムービー コントローラー
コントローラー























 Z
Z Y
Y X
X