+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Escherichia coli Rho-dependent transcription pre-termination complex containing 21 nt long RNA spacer, Mg-ADP-BeF3, and NusG; Rho hexamer part | |||||||||
 マップデータ マップデータ | Escherichia coli Rho-dependent transcription pre-termination complex containing 21 nt long RNA spacer, Mg-ADP-BeF3, and NusG; Rho hexamer part | |||||||||
 試料 試料 |
| |||||||||
 キーワード キーワード | factor-dependent termination / Rho / transcription termination / transcription elongation complex / helicase / ATPase / TRANSCRIPTION-RNA complex | |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報ATP-dependent activity, acting on RNA / helicase activity / DNA-templated transcription termination / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / ATP hydrolysis activity / RNA binding / ATP binding / cytosol 類似検索 - 分子機能 | |||||||||
| 生物種 |  | |||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 4.2 Å | |||||||||
 データ登録者 データ登録者 | Molodtsov V / Wang C | |||||||||
| 資金援助 |  米国, 1件 米国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nature / 年: 2023 ジャーナル: Nature / 年: 2023タイトル: Structural basis of Rho-dependent transcription termination. 著者: Vadim Molodtsov / Chengyuan Wang / Emre Firlar / Jason T Kaelber / Richard H Ebright /  要旨: Rho is a ring-shaped hexameric ATP-dependent molecular motor. Together with the transcription elongation factor NusG, Rho mediates factor-dependent transcription termination and transcription- ...Rho is a ring-shaped hexameric ATP-dependent molecular motor. Together with the transcription elongation factor NusG, Rho mediates factor-dependent transcription termination and transcription-translation-coupling quality control in Escherichia coli. Here we report the preparation of complexes that are functional in factor-dependent transcription termination from Rho, NusG, RNA polymerase (RNAP), and synthetic nucleic acid scaffolds, and we report cryogenic electron microscopy structures of the complexes. The structures show that functional factor-dependent pre-termination complexes contain a closed-ring Rho hexamer; have RNA threaded through the central channel of Rho; have 60 nucleotides of RNA interacting sequence-specifically with the exterior of Rho and 6 nucleotides of RNA interacting sequence-specifically with the central channel of Rho; have Rho oriented relative to RNAP such that ATP-dependent translocation by Rho exerts mechanical force on RNAP; and have NusG bridging Rho and RNAP. The results explain five decades of research on Rho and provide a foundation for understanding Rho's function. #1:  ジャーナル: Biorxiv / 年: 2022 ジャーナル: Biorxiv / 年: 2022タイトル: Structural basis of Rho-dependent transcription termination 著者: Molodtsov V / Wang C / Firlar E / Kaelber JT / Ebright RH | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27914.map.gz emd_27914.map.gz | 135.8 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27914-v30.xml emd-27914-v30.xml emd-27914.xml emd-27914.xml | 18.3 KB 18.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_27914.png emd_27914.png | 20.7 KB | ||
| Filedesc metadata |  emd-27914.cif.gz emd-27914.cif.gz | 5.7 KB | ||
| その他 |  emd_27914_half_map_1.map.gz emd_27914_half_map_1.map.gz emd_27914_half_map_2.map.gz emd_27914_half_map_2.map.gz | 146.1 MB 146.1 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27914 http://ftp.pdbj.org/pub/emdb/structures/EMD-27914 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27914 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27914 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_27914_validation.pdf.gz emd_27914_validation.pdf.gz | 850.5 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_27914_full_validation.pdf.gz emd_27914_full_validation.pdf.gz | 850 KB | 表示 | |
| XML形式データ |  emd_27914_validation.xml.gz emd_27914_validation.xml.gz | 15.2 KB | 表示 | |
| CIF形式データ |  emd_27914_validation.cif.gz emd_27914_validation.cif.gz | 17.8 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27914 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27914 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27914 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27914 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8e5lMC  8e3fC  8e3hC  8e5kC  8e5oC  8e5pC  8e6wC  8e6xC  8e6zC  8e70C C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27914.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27914.map.gz / 形式: CCP4 / 大きさ: 216 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Escherichia coli Rho-dependent transcription pre-termination complex containing 21 nt long RNA spacer, Mg-ADP-BeF3, and NusG; Rho hexamer part | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.038 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: Half-map 1 Escherichia coli Rho-dependent transcription pre-termination complex...
| ファイル | emd_27914_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half-map 1 Escherichia coli Rho-dependent transcription pre-termination complex containing 21 nt long RNA spacer, Mg-ADP-BeF3, and NusG; Rho hexamer part | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: Half-map 2 Escherichia coli Rho-dependent transcription pre-termination complex...
| ファイル | emd_27914_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | Half-map 2 Escherichia coli Rho-dependent transcription pre-termination complex containing 21 nt long RNA spacer, Mg-ADP-BeF3, and NusG; Rho hexamer part | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Escherichia coli Rho-dependent transcription pre-termination comp...
| 全体 | 名称: Escherichia coli Rho-dependent transcription pre-termination complex containing 21 nt long RNA spacer, Mg-ADP-BeF3, and NusG; Rho hexamer part |
|---|---|
| 要素 |
|
-超分子 #1: Escherichia coli Rho-dependent transcription pre-termination comp...
| 超分子 | 名称: Escherichia coli Rho-dependent transcription pre-termination complex containing 21 nt long RNA spacer, Mg-ADP-BeF3, and NusG; Rho hexamer part タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1-#2 |
|---|---|
| 由来(天然) | 生物種:  |
-分子 #1: RNA with 21 nt long spacer
| 分子 | 名称: RNA with 21 nt long spacer / タイプ: rna / ID: 1 / コピー数: 1 |
|---|---|
| 由来(天然) | 生物種: synthetic construct (人工物) |
| 分子量 | 理論値: 11.99382 KDa |
| 配列 | 文字列: AUGUUUUUUU UUUUUUUUUU UUUUGAUUUG GUGAGAGG |
-分子 #2: Transcription termination factor Rho
| 分子 | 名称: Transcription termination factor Rho / タイプ: protein_or_peptide / ID: 2 / コピー数: 6 / 光学異性体: LEVO EC番号: 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 47.070168 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MNLTELKNTP VSELITLGEN MGLENLARMR KQDIIFAILK QHAKSGEDIF GDGVLEILQD GFGFLRSADS SYLAGPDDIY VSPSQIRRF NLRTGDTISG KIRPPKEGER YFALLKVNEV NFDKPENARN KILFENLTPL HANSRLRMER GNGSTEDLTA R VLDLASPI ...文字列: MNLTELKNTP VSELITLGEN MGLENLARMR KQDIIFAILK QHAKSGEDIF GDGVLEILQD GFGFLRSADS SYLAGPDDIY VSPSQIRRF NLRTGDTISG KIRPPKEGER YFALLKVNEV NFDKPENARN KILFENLTPL HANSRLRMER GNGSTEDLTA R VLDLASPI GRGQRGLIVA PPKAGKTMLL QNIAQSIAYN HPDCVLMVLL IDERPEEVTE MQRLVKGEVV ASTFDEPASR HV QVAEMVI EKAKRLVEHK KDVIILLDSI TRLARAYNTV VPASGKVLTG GVDANALHRP KRFFGAARNV EEGGSLTIIA TAL IDTGSK MDEVIYEEFK GTGNMELHLS RKIAEKRVFP AIDYNRSGTR KEELLTTQEE LQKMWILRKI IHPMGEIDAM EFLI NKLAM TKTNDDFFEM MKRS UniProtKB: Transcription termination factor Rho |
-分子 #3: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 3 / コピー数: 6 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #4: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 4 / コピー数: 6 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-分子 #5: BERYLLIUM TRIFLUORIDE ION
| 分子 | 名称: BERYLLIUM TRIFLUORIDE ION / タイプ: ligand / ID: 5 / コピー数: 6 / 式: BEF |
|---|---|
| 分子量 | 理論値: 66.007 Da |
| Chemical component information | 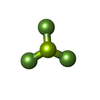 ChemComp-BEF: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.9 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TALOS ARCTICA |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 平均電子線量: 28.0 e/Å2 |
| 電子線 | 加速電圧: 200 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 1.25 µm |
| 実験機器 |  モデル: Talos Arctica / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 4.2 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 31098 |
| 初期 角度割当 | タイプ: COMMON LINE |
| 最終 角度割当 | タイプ: COMMON LINE |
 ムービー
ムービー コントローラー
コントローラー





















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)