+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | hBest1 5mM Ca2+ (Ca2+-bound) closed state | ||||||||||||
 マップデータ マップデータ | servalcat map | ||||||||||||
 試料 試料 |
| ||||||||||||
 キーワード キーワード | Ion channel / chloride channel / anion channel / pentamer / TRANSPORT PROTEIN | ||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報membrane microdomain / bicarbonate channel activity / transepithelial chloride transport / ligand-gated channel activity / gamma-aminobutyric acid secretion, neurotransmission / detection of light stimulus involved in visual perception / intracellularly calcium-gated chloride channel activity / glutamate secretion / bicarbonate transmembrane transporter activity / chloride transport ...membrane microdomain / bicarbonate channel activity / transepithelial chloride transport / ligand-gated channel activity / gamma-aminobutyric acid secretion, neurotransmission / detection of light stimulus involved in visual perception / intracellularly calcium-gated chloride channel activity / glutamate secretion / bicarbonate transmembrane transporter activity / chloride transport / chloride channel activity / regulation of calcium ion transport / chloride channel complex / monoatomic ion transmembrane transport / visual perception / basal plasma membrane / regulation of synaptic plasticity / Stimuli-sensing channels / presynapse / protein complex oligomerization / basolateral plasma membrane / identical protein binding / membrane / plasma membrane / cytosol 類似検索 - 分子機能 | ||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 2.05 Å | ||||||||||||
 データ登録者 データ登録者 | Owji AP / Kittredge A / Hendrickson WA / Tingting Y | ||||||||||||
| 資金援助 |  米国, 3件 米国, 3件
| ||||||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Structures and gating mechanisms of human bestrophin anion channels. 著者: Aaron P Owji / Jiali Wang / Alec Kittredge / Zada Clark / Yu Zhang / Wayne A Hendrickson / Tingting Yang /  要旨: Bestrophin-1 (Best1) and bestrophin-2 (Best2) are two members of the bestrophin family of calcium (Ca)-activated chloride (Cl) channels with critical involvement in ocular physiology and direct ...Bestrophin-1 (Best1) and bestrophin-2 (Best2) are two members of the bestrophin family of calcium (Ca)-activated chloride (Cl) channels with critical involvement in ocular physiology and direct pathological relevance. Here, we report cryo-EM structures of wild-type human Best1 and Best2 in various states at up to 1.8 Å resolution. Ca-bound Best1 structures illustrate partially open conformations at the two Ca-dependent gates of the channels, in contrast to the fully open conformations observed in Ca-bound Best2, which is in accord with the significantly smaller currents conducted by Best1 in electrophysiological recordings. Comparison of the closed and open states reveals a C-terminal auto-inhibitory segment (AS), which constricts the channel concentrically by wrapping around the channel periphery in an inter-protomer manner and must be released to allow channel opening. Our results demonstrate that removing the AS from Best1 and Best2 results in truncation mutants with similar activities, while swapping the AS between Best1 and Best2 results in chimeric mutants with swapped activities, underlying a key role of the AS in determining paralog specificity among bestrophins. | ||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_27132.map.gz emd_27132.map.gz | 78.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-27132-v30.xml emd-27132-v30.xml emd-27132.xml emd-27132.xml | 21.9 KB 21.9 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_27132.png emd_27132.png | 203.8 KB | ||
| Filedesc metadata |  emd-27132.cif.gz emd-27132.cif.gz | 6.2 KB | ||
| その他 |  emd_27132_additional_1.map.gz emd_27132_additional_1.map.gz emd_27132_half_map_1.map.gz emd_27132_half_map_1.map.gz emd_27132_half_map_2.map.gz emd_27132_half_map_2.map.gz | 123.2 MB 226.7 MB 226.7 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-27132 http://ftp.pdbj.org/pub/emdb/structures/EMD-27132 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27132 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-27132 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_27132_validation.pdf.gz emd_27132_validation.pdf.gz | 976.7 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_27132_full_validation.pdf.gz emd_27132_full_validation.pdf.gz | 976.3 KB | 表示 | |
| XML形式データ |  emd_27132_validation.xml.gz emd_27132_validation.xml.gz | 15.8 KB | 表示 | |
| CIF形式データ |  emd_27132_validation.cif.gz emd_27132_validation.cif.gz | 17.7 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27132 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27132 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27132 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-27132 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8d1jMC  8d1eC  8d1fC  8d1gC  8d1hC  8d1iC  8d1kC  8d1lC  8d1mC  8d1nC  8d1oC C: 同じ文献を引用 ( M: このマップから作成された原子モデル |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_27132.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_27132.map.gz / 形式: CCP4 / 大きさ: 83.7 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | servalcat map | ||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 0.51235 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-追加マップ: full map
| ファイル | emd_27132_additional_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | full map | ||||||||||||
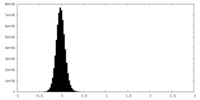
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: half map 1
| ファイル | emd_27132_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map 1 | ||||||||||||
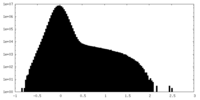
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: half map 2
| ファイル | emd_27132_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : hBest1 5mM Ca2+ (Ca2+-bound) closed state
| 全体 | 名称: hBest1 5mM Ca2+ (Ca2+-bound) closed state |
|---|---|
| 要素 |
|
-超分子 #1: hBest1 5mM Ca2+ (Ca2+-bound) closed state
| 超分子 | 名称: hBest1 5mM Ca2+ (Ca2+-bound) closed state / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 338 KDa |
-分子 #1: Bestrophin-1
| 分子 | 名称: Bestrophin-1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 5 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 67.760469 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MTITYTSQVA NARLGSFSRL LLCWRGSIYK LLYGEFLIFL LCYYIIRFIY RLALTEEQQL MFEKLTLYCD SYIQLIPISF VLGFYVTLV VTRWWNQYEN LPWPDRLMSL VSGFVEGKDE QGRLLRRTLI RYANLGNVLI LRSVSTAVYK RFPSAQHLVQ A GFMTPAEH ...文字列: MTITYTSQVA NARLGSFSRL LLCWRGSIYK LLYGEFLIFL LCYYIIRFIY RLALTEEQQL MFEKLTLYCD SYIQLIPISF VLGFYVTLV VTRWWNQYEN LPWPDRLMSL VSGFVEGKDE QGRLLRRTLI RYANLGNVLI LRSVSTAVYK RFPSAQHLVQ A GFMTPAEH KQLEKLSLPH NMFWVPWVWF ANLSMKAWLG GRIRDPILLQ SLLNEMNTLR TQCGHLYAYD WISIPLVYTQ VV TVAVYSF FLTCLVGRQF LNPAKAYPGH ELDLVVPVFT FLQFFFYVGW LKVAEQLINP FGEDDDDFET NWIVDRNLQV SLL AVDEMH QDLPRMEPDM YWNKPEPQPP YTAASAQFRR ASFMGSTFNI SLNKEEMEFQ PNQEDEEDAH AGIIGRFLGL QSHD HHPPR ANSRTKLLWP KRESLLHEGL PKNHKAAKQN VRGQEDNKAW KLKAVDAFKS APLYQRPGYY SAPQTPLSPT PMFFP LEPS APSKLHSVTG IDTKDKSLKT VSSGAKKSFE LLSESDGALM EHPEVSQVRR KTVEFNLTDM PEIPENHLKE PLEQSP TNI HTTLKDHMDP YWALENRDEA HS UniProtKB: Bestrophin-1 |
-分子 #2: CALCIUM ION
| 分子 | 名称: CALCIUM ION / タイプ: ligand / ID: 2 / コピー数: 5 / 式: CA |
|---|---|
| 分子量 | 理論値: 40.078 Da |
-分子 #3: 1,2-DIMYRISTOYL-RAC-GLYCERO-3-PHOSPHOCHOLINE
| 分子 | 名称: 1,2-DIMYRISTOYL-RAC-GLYCERO-3-PHOSPHOCHOLINE / タイプ: ligand / ID: 3 / コピー数: 40 / 式: MC3 |
|---|---|
| 分子量 | 理論値: 677.933 Da |
| Chemical component information | 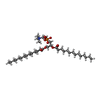 ChemComp-MC3: |
-分子 #4: water
| 分子 | 名称: water / タイプ: ligand / ID: 4 / コピー数: 846 / 式: HOH |
|---|---|
| 分子量 | 理論値: 18.015 Da |
| Chemical component information |  ChemComp-HOH: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 5 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.8 構成要素:
| ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 100 % / チャンバー内温度: 283.15 K / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 特殊光学系 | エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 実像数: 2047 / 平均電子線量: 58.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.0 µm / 最小 デフォーカス(公称値): 1.0 µm |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー














 Z
Z Y
Y X
X