+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Structure of Importin-4 bound to the H3-H4-ASF1 histone-histone chaperone complex | |||||||||||||||
 マップデータ マップデータ | ||||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | Importin / Nuclear Import / Chaperone / Histones / H3 / H4 / ASF1 / NUCLEAR PROTEIN | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報: / nucleosome disassembly / nuclear import signal receptor activity / nuclear localization sequence binding / protein localization to nucleus / small GTPase binding / structural constituent of chromatin / protein import into nucleus / nucleosome / nucleosome assembly ...: / nucleosome disassembly / nuclear import signal receptor activity / nuclear localization sequence binding / protein localization to nucleus / small GTPase binding / structural constituent of chromatin / protein import into nucleus / nucleosome / nucleosome assembly / histone binding / protein heterodimerization activity / chromatin / protein-containing complex / DNA binding / membrane / nucleus / cytoplasm 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  | |||||||||||||||
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.45 Å | |||||||||||||||
 データ登録者 データ登録者 | Bernardes NE / Chook YM / Fung HYJ / Chen Z / Li Y | |||||||||||||||
| 資金援助 |  米国, 4件 米国, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: Proc Natl Acad Sci U S A / 年: 2022 ジャーナル: Proc Natl Acad Sci U S A / 年: 2022タイトル: Structure of IMPORTIN-4 bound to the H3-H4-ASF1 histone-histone chaperone complex. 著者: Natália Elisa Bernardes / Ho Yee Joyce Fung / Yang Li / Zhe Chen / Yuh Min Chook /  要旨: IMPORTIN-4, the primary nuclear import receptor of core histones H3 and H4, binds the H3-H4 dimer and histone chaperone ASF1 prior to nuclear import. However, how H3-H3-ASF1 is recognized for ...IMPORTIN-4, the primary nuclear import receptor of core histones H3 and H4, binds the H3-H4 dimer and histone chaperone ASF1 prior to nuclear import. However, how H3-H3-ASF1 is recognized for transport cannot be explained by available crystal structures of IMPORTIN-4-histone tail peptide complexes. Our 3.5-Å IMPORTIN-4-H3-H4-ASF1 cryoelectron microscopy structure reveals the full nuclear import complex and shows a binding mode different from suggested by previous structures. The N-terminal half of IMPORTIN-4 clamps the globular H3-H4 domain and H3 αN helix, while its C-terminal half binds the H3 N-terminal tail weakly; tail contribution to binding energy is negligible. ASF1 binds H3-H4 without contacting IMPORTIN-4. Together, ASF1 and IMPORTIN-4 shield nucleosomal H3-H4 surfaces to chaperone and import it into the nucleus where RanGTP binds IMPORTIN-4, causing large conformational changes to release H3-H4-ASF1. This work explains how full-length H3-H4 binds IMPORTIN-4 in the cytoplasm and how it is released in the nucleus. | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_26625.map.gz emd_26625.map.gz | 52.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-26625-v30.xml emd-26625-v30.xml emd-26625.xml emd-26625.xml | 19.5 KB 19.5 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_26625.png emd_26625.png | 42 KB | ||
| Filedesc metadata |  emd-26625.cif.gz emd-26625.cif.gz | 6.6 KB | ||
| その他 |  emd_26625_half_map_1.map.gz emd_26625_half_map_1.map.gz emd_26625_half_map_2.map.gz emd_26625_half_map_2.map.gz | 95.6 MB 95.6 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-26625 http://ftp.pdbj.org/pub/emdb/structures/EMD-26625 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-26625 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-26625 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_26625_validation.pdf.gz emd_26625_validation.pdf.gz | 971.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_26625_full_validation.pdf.gz emd_26625_full_validation.pdf.gz | 971.3 KB | 表示 | |
| XML形式データ |  emd_26625_validation.xml.gz emd_26625_validation.xml.gz | 13.2 KB | 表示 | |
| CIF形式データ |  emd_26625_validation.cif.gz emd_26625_validation.cif.gz | 15.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26625 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26625 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26625 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-26625 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  7unkMC  8dyoC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_26625.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_26625.map.gz / 形式: CCP4 / 大きさ: 103 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 0.834 Å | ||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: #1
| ファイル | emd_26625_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
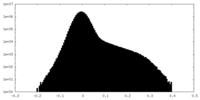
| 投影像・断面図 |
| ||||||||||||
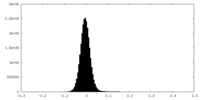
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_26625_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
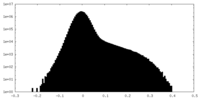
| 投影像・断面図 |
| ||||||||||||
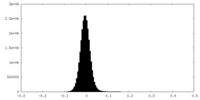
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Nuclear import complex of Imp4-H3-H4-Asf1
| 全体 | 名称: Nuclear import complex of Imp4-H3-H4-Asf1 |
|---|---|
| 要素 |
|
-超分子 #1: Nuclear import complex of Imp4-H3-H4-Asf1
| 超分子 | 名称: Nuclear import complex of Imp4-H3-H4-Asf1 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: all |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 167 KDa |
-分子 #1: Importin-4
| 分子 | 名称: Importin-4 / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 118.83207 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MESAGLEQLL RELLLPDTER IRRATEQLQI VLRAPAALPA LCDLLASAAD PQIRQFAAVL TRRRLNTRWR RLAAEQRESL KSLILTALQ RETEHCVSLS LAQLSATIFR KEGLEAWPQL LQLLQHSTHS PHSPEREMGL LLLSVVVTSR PEAFQPHHRE L LRLLNETL ...文字列: MESAGLEQLL RELLLPDTER IRRATEQLQI VLRAPAALPA LCDLLASAAD PQIRQFAAVL TRRRLNTRWR RLAAEQRESL KSLILTALQ RETEHCVSLS LAQLSATIFR KEGLEAWPQL LQLLQHSTHS PHSPEREMGL LLLSVVVTSR PEAFQPHHRE L LRLLNETL GEVGSPGLLF YSLRTLTTMA PYLSTEDVPL ARMLVPKLIM AMQTLIPIDE AKACEALEAL DELLESEVPV IT PYLSEVL TFCLEVARNV ALGNAIRIRI LCCLTFLVKV KSKALLKNRL LPPLLHTLFP IVAAEPPPGQ LDPEDQDSEE EEL EIELMG ETPKHFAVQV VDMLALHLPP EKLCPQLMPM LEEALRSESP YQRKAGLLVL AVLSDGAGDH IRQRLLPPLL QIVC KGLED PSQVVRNAAL FALGQFSENL QPHISSYSRE VMPLLLAYLK SVPLGHTHHL AKACYALENF VENLGPKVQP YLPEL MECM LQLLRNPSSP RAKELAVSAL GAIATAAQAS LLPYFPAIME HLREFLLTGR EDLQPVQIQS LETLGVLARA VGEPMR PLA EECCQLGLGL CDQVDDPDLR RCTYSLFAAL SGLMGEGLAP HLEQITTLML LSLRSTEGIV PQYDGSSSFL LFDDESD GE EEEELMDEDV EEEDDSEISG YSVENAFFDE KEDTCAAVGE ISVNTSVAFL PYMESVFEEV FKLLECPHLN VRKAAHEA L GQFCCALHKA CQSCPSEPNT AALQAALARV VPSYMQAVNR ERERQVVMAV LEALTGVLRS CGTLTLKPPG RLAELCGVL KAVLQRKTAC QDTDEEEEEE DDDQAEYDAM LLEHAGEAIP ALAAAAGGDS FAPFFAGFLP LLVCKTKQGC TVAEKSFAVG TLAETIQGL GAASAQFVSR LLPVLLSTAQ EADPEVRSNA IFGMGVLAEH GGHPAQEHFP KLLGLLFPLL ARERHDRVRD N ICGALARL LMASPTRKPE PQVLAALLHA LPLKEDLEEW VTIGRLFSFL YQSSPDQVID VAPELLRICS LILADNKIPP DT KAALLLL LTFLAKQHTD SFQAALGSLP VDKAQELQAV LGLS UniProtKB: Importin-4 |
-分子 #2: Histone H3
| 分子 | 名称: Histone H3 / タイプ: protein_or_peptide / ID: 2 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 15.407075 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MARTKQTARK STGGKAPRKQ LATKAARKSA PATGGVKKPH RYRPGTVALR EIRRYQKSTE LLIRKLPFQR LVREIAQDFK TDLRFQSSA VMALQEASEA YLVGLFEDTN LCGIHAKRVT IMPKDIQLAR RIRGERA UniProtKB: Histone H3 |
-分子 #3: Histone chaperone
| 分子 | 名称: Histone chaperone / タイプ: protein_or_peptide / ID: 3 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  |
| 分子量 | 理論値: 31.62926 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSIVSLLGIK VLNNPAKFTD PYEFEITFEC LESLKHDLEW KLTYVGSSRS LDHDQELDSI LVGPVPVGVN KFVFSADPPS AELIPASEL VSVTVILLSC SYDGREFVRV GYYVNNEYDE EELRENPPAK VQVDHIVRNI LAEKPRVTRF NIVWDNENEG D LYPPEQPG ...文字列: MSIVSLLGIK VLNNPAKFTD PYEFEITFEC LESLKHDLEW KLTYVGSSRS LDHDQELDSI LVGPVPVGVN KFVFSADPPS AELIPASEL VSVTVILLSC SYDGREFVRV GYYVNNEYDE EELRENPPAK VQVDHIVRNI LAEKPRVTRF NIVWDNENEG D LYPPEQPG VDDEEEEDDE EEDDDEDDED DEDDDQEDGE GEAEEAAEEE EEEEEKTEDN ETNLEEEEED IENSDGDEEE GE EEVGSVD KNEDGNDKKR RKIEGGSTDI ESTPKDAARS TN UniProtKB: Histone chaperone |
-分子 #4: Histone H4
| 分子 | 名称: Histone H4 / タイプ: protein_or_peptide / ID: 4 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種: |
| 分子量 | 理論値: 11.394426 KDa |
| 組換発現 | 生物種:  |
| 配列 | 文字列: MSGRGKGGKG LGKGGAKRHR KVLRDNIQGI TKPAIRRLAR RGGVKRISGL IYEETRGVLK VFLENVIRDA VTYTEHAKRK TVTAMDVVY ALKRQGRTLY GFGG UniProtKB: Histone H4 |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 緩衝液 | pH: 7.5 |
|---|---|
| グリッド | モデル: Quantifoil / 材質: COPPER / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 前処理 - タイプ: GLOW DISCHARGE |
| 凍結 | 凍結剤: ETHANE / 装置: FEI VITROBOT MARK IV |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 平均電子線量: 52.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / 最大 デフォーカス(公称値): -2.5 µm / 最小 デフォーカス(公称値): -1.0 µm |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 初期モデル | モデルのタイプ: NONE |
|---|---|
| 最終 再構成 | 解像度のタイプ: BY AUTHOR / 解像度: 3.45 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 146050 |
| 初期 角度割当 | タイプ: NOT APPLICABLE |
| 最終 角度割当 | タイプ: NOT APPLICABLE |
-原子モデル構築 1
| 精密化 | 空間: REAL / プロトコル: RIGID BODY FIT |
|---|---|
| 得られたモデル |  PDB-7unk: |
 ムービー
ムービー コントローラー
コントローラー









 Z
Z Y
Y X
X