+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 |  | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Human arginylated beta-actin | |||||||||||||||
 マップデータ マップデータ | R-actin monomer map | |||||||||||||||
 試料 試料 |
| |||||||||||||||
 キーワード キーワード | actin / methylated / filament / CONTRACTILE PROTEIN | |||||||||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報positive regulation of norepinephrine uptake / cellular response to cytochalasin B / regulation of transepithelial transport / morphogenesis of a polarized epithelium / bBAF complex / postsynaptic actin cytoskeleton organization / protein localization to adherens junction / postsynaptic actin cytoskeleton / npBAF complex / Tat protein binding ...positive regulation of norepinephrine uptake / cellular response to cytochalasin B / regulation of transepithelial transport / morphogenesis of a polarized epithelium / bBAF complex / postsynaptic actin cytoskeleton organization / protein localization to adherens junction / postsynaptic actin cytoskeleton / npBAF complex / Tat protein binding / structural constituent of postsynaptic actin cytoskeleton / brahma complex / nBAF complex / GBAF complex / dense body / regulation of G0 to G1 transition / Formation of annular gap junctions / Gap junction degradation / Cell-extracellular matrix interactions / Folding of actin by CCT/TriC / apical protein localization / regulation of double-strand break repair / regulation of nucleotide-excision repair / adherens junction assembly / Prefoldin mediated transfer of substrate to CCT/TriC / RHOF GTPase cycle / RSC-type complex / Adherens junctions interactions / tight junction / Sensory processing of sound by outer hair cells of the cochlea / regulation of norepinephrine uptake / Interaction between L1 and Ankyrins / regulation of mitotic metaphase/anaphase transition / Sensory processing of sound by inner hair cells of the cochlea / SWI/SNF complex / positive regulation of double-strand break repair / regulation of synaptic vesicle endocytosis / positive regulation of T cell differentiation / apical junction complex / establishment or maintenance of cell polarity / regulation of cyclin-dependent protein serine/threonine kinase activity / cortical cytoskeleton / maintenance of blood-brain barrier / positive regulation of stem cell population maintenance / NuA4 histone acetyltransferase complex / nitric-oxide synthase binding / regulation of G1/S transition of mitotic cell cycle / Recycling pathway of L1 / kinesin binding / brush border / calyx of Held / negative regulation of cell differentiation / positive regulation of double-strand break repair via homologous recombination / EPH-ephrin mediated repulsion of cells / RHO GTPases Activate WASPs and WAVEs / RHO GTPases activate IQGAPs / regulation of protein localization to plasma membrane / positive regulation of myoblast differentiation / EPHB-mediated forward signaling / substantia nigra development / axonogenesis / negative regulation of protein binding / Translocation of SLC2A4 (GLUT4) to the plasma membrane / RHO GTPases Activate Formins / cell motility / actin filament / positive regulation of cell differentiation / adherens junction / FCGR3A-mediated phagocytosis / regulation of transmembrane transporter activity / 加水分解酵素; 酸無水物に作用; 酸無水物に作用・細胞または細胞小器官の運動に関与 / DNA Damage Recognition in GG-NER / Signaling by high-kinase activity BRAF mutants / Schaffer collateral - CA1 synapse / MAP2K and MAPK activation / tau protein binding / B-WICH complex positively regulates rRNA expression / structural constituent of cytoskeleton / Regulation of actin dynamics for phagocytic cup formation / kinetochore / platelet aggregation / nuclear matrix / VEGFA-VEGFR2 Pathway / cytoplasmic ribonucleoprotein granule / Signaling by RAF1 mutants / Signaling by moderate kinase activity BRAF mutants / Paradoxical activation of RAF signaling by kinase inactive BRAF / Signaling downstream of RAS mutants / UCH proteinases / nucleosome / Signaling by BRAF and RAF1 fusions / cell-cell junction / actin cytoskeleton / presynapse / lamellipodium / Clathrin-mediated endocytosis / Factors involved in megakaryocyte development and platelet production / HATs acetylate histones / regulation of apoptotic process / vesicle 類似検索 - 分子機能 | |||||||||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||
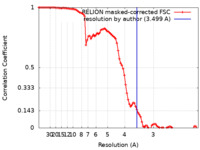
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.499 Å | |||||||||||||||
 データ登録者 データ登録者 | Pinto CS / Bakker SE / Suchenko A / Hussain H / Hatano T / Sampath K / Chinthalapudi K / Mishima M / Balasubramanian M | |||||||||||||||
| 資金援助 |  英国, European Union, 4件 英国, European Union, 4件
| |||||||||||||||
 引用 引用 |  ジャーナル: To Be Published ジャーナル: To Be Publishedタイトル: Structure and physiological investigation of human arginylated beta-actin 著者: Pinto CS / Bakker SE / Suchenko A / Hussain H / Hatano T / Sampath K / Chinthalapudi K / Mishima M / Balasubramanian M | |||||||||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 添付画像 |
|---|
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_16776.map.gz emd_16776.map.gz | 3.9 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-16776-v30.xml emd-16776-v30.xml emd-16776.xml emd-16776.xml | 16.6 KB 16.6 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_16776_fsc.xml emd_16776_fsc.xml | 9.1 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_16776.png emd_16776.png | 180.8 KB | ||
| Filedesc metadata |  emd-16776.cif.gz emd-16776.cif.gz | 5.9 KB | ||
| その他 |  emd_16776_half_map_1.map.gz emd_16776_half_map_1.map.gz emd_16776_half_map_2.map.gz emd_16776_half_map_2.map.gz | 49.5 MB 49.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-16776 http://ftp.pdbj.org/pub/emdb/structures/EMD-16776 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16776 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-16776 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_16776_validation.pdf.gz emd_16776_validation.pdf.gz | 656.8 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_16776_full_validation.pdf.gz emd_16776_full_validation.pdf.gz | 656.4 KB | 表示 | |
| XML形式データ |  emd_16776_validation.xml.gz emd_16776_validation.xml.gz | 16 KB | 表示 | |
| CIF形式データ |  emd_16776_validation.cif.gz emd_16776_validation.cif.gz | 21.1 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16776 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16776 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16776 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-16776 | HTTPS FTP |
-関連構造データ
| 関連構造データ |  8cogMC M: このマップから作成された原子モデル C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_16776.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_16776.map.gz / 形式: CCP4 / 大きさ: 64 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | R-actin monomer map | ||||||||||||||||||||||||||||||||||||
| 投影像・断面図 | 画像のコントロール
画像は Spider により作成 | ||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.08 Å | ||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
|
-添付データ
-ハーフマップ: half-map 1
| ファイル | emd_16776_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half-map 1 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: half-map 2
| ファイル | emd_16776_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | half-map 2 | ||||||||||||
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : Polymerised arginylated actin with bound ADP
| 全体 | 名称: Polymerised arginylated actin with bound ADP |
|---|---|
| 要素 |
|
-超分子 #1: Polymerised arginylated actin with bound ADP
| 超分子 | 名称: Polymerised arginylated actin with bound ADP / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Actin, cytoplasmic 1, N-terminally processed
| 分子 | 名称: Actin, cytoplasmic 1, N-terminally processed / タイプ: protein_or_peptide / ID: 1 / コピー数: 1 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 41.70659 KDa |
| 組換発現 | 生物種:  Komagataella pastoris (菌類) Komagataella pastoris (菌類) |
| 配列 | 文字列: RDDIAALVVD NGSGMCKAGF AGDDAPRAVF PSIVGRPRHQ GVMVGMGQKD SYVGDEAQSK RGILTLKYPI E(HIC)GIVT NWD DMEKIWHHTF YNELRVAPEE HPVLLTEAPL NPKANREKMT QIMFETFNTP AMYVAIQAVL SLYASGRTTG IVMDSGD GV ...文字列: RDDIAALVVD NGSGMCKAGF AGDDAPRAVF PSIVGRPRHQ GVMVGMGQKD SYVGDEAQSK RGILTLKYPI E(HIC)GIVT NWD DMEKIWHHTF YNELRVAPEE HPVLLTEAPL NPKANREKMT QIMFETFNTP AMYVAIQAVL SLYASGRTTG IVMDSGD GV THTVPIYEGY ALPHAILRLD LAGRDLTDYL MKILTERGYS FTTTAEREIV RDIKEKLCYV ALDFEQEMAT AASSSSLE K SYELPDGQVI TIGNERFRCP EALFQPSFLG MESCGIHETT FNSIMKCDVD IRKDLYANTV LSGGTTMYPG IADRMQKEI TALAPSTMKI KIIAPPERKY SVWIGGSILA SLSTFQQMWI SKQEYDESGP SIVHRKCF UniProtKB: Actin, cytoplasmic 1 |
-分子 #2: ADENOSINE-5'-DIPHOSPHATE
| 分子 | 名称: ADENOSINE-5'-DIPHOSPHATE / タイプ: ligand / ID: 2 / コピー数: 1 / 式: ADP |
|---|---|
| 分子量 | 理論値: 427.201 Da |
| Chemical component information |  ChemComp-ADP: |
-分子 #3: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 3 / コピー数: 1 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 緩衝液 | pH: 7.4 詳細: Actin for EM was polymerized by mixing, 20 ul 20 uM G-actin, 8 ul 10x MKE and 52 ul 5 mM HEPES-KOH pH 7.4 containing 0.2 mM ATP and 0.5 mM DTT and incubating at RT for 1 hour. |
|---|---|
| グリッド | モデル: Quantifoil R3.5/1 / 材質: COPPER / メッシュ: 200 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY ARRAY / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 時間: 60 sec. / 前処理 - 雰囲気: AIR |
| 凍結 | 凍結剤: ETHANE-PROPANE / チャンバー内湿度: 95 % / チャンバー内温度: 277 K / 装置: LEICA EM GP |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / 撮影したグリッド数: 1 / 平均露光時間: 60.0 sec. / 平均電子線量: 42.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 50.0 µm / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 1.5 µm 最小 デフォーカス(公称値): 0.7000000000000001 µm 倍率(公称値): 75000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
 ムービー
ムービー コントローラー
コントローラー





















 Z (Sec.)
Z (Sec.) Y (Row.)
Y (Row.) X (Col.)
X (Col.)