+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-12073 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | Cryo-EM Structure of Human Thyroglobulin | |||||||||
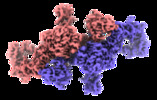
 マップデータ マップデータ | human Thyroglobulin, composite map | |||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報iodide transport / hormone biosynthetic process / thyroid hormone generation / regulation of myelination / thyroid gland development / hormone activity / signal transduction / extracellular space / extracellular region / identical protein binding 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) / Homo sapiens (ヒト) /  Human (ヒト) Human (ヒト) | |||||||||
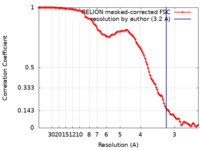
| 手法 | 単粒子再構成法 / クライオ電子顕微鏡法 / 解像度: 3.2 Å | |||||||||
 データ登録者 データ登録者 | Adaixo R / Righetto R / Steiner EM / Taylor NMI / Stahlberg H | |||||||||
| 資金援助 |  デンマーク, 2件 デンマーク, 2件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2022 ジャーナル: Nat Commun / 年: 2022タイトル: Cryo-EM structure of native human thyroglobulin. 著者: Ricardo Adaixo / Eva M Steiner / Ricardo D Righetto / Alexander Schmidt / Henning Stahlberg / Nicholas M I Taylor /   要旨: The thyroglobulin (TG) protein is essential to thyroid hormone synthesis, plays a vital role in the regulation of metabolism, development and growth and serves as intraglandular iodine storage. Its ...The thyroglobulin (TG) protein is essential to thyroid hormone synthesis, plays a vital role in the regulation of metabolism, development and growth and serves as intraglandular iodine storage. Its architecture is conserved among vertebrates. Synthesis of triiodothyronine (T) and thyroxine (T) hormones depends on the conformation, iodination and post-translational modification of TG. Although structural information is available on recombinant and deglycosylated endogenous human thyroglobulin (hTG) from patients with goiters, the structure of native, fully glycosylated hTG remained unknown. Here, we present the cryo-electron microscopy structure of native and fully glycosylated hTG from healthy thyroid glands to 3.2 Å resolution. The structure provides detailed information on hormonogenic and glycosylation sites. We employ liquid chromatography-mass spectrometry (LC-MS) to validate these findings as well as other post-translational modifications and proteolytic cleavage sites. Our results offer insights into thyroid hormonogenesis of native hTG and provide a fundamental understanding of clinically relevant mutations. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_12073.map.gz emd_12073.map.gz | 9.6 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-12073-v30.xml emd-12073-v30.xml emd-12073.xml emd-12073.xml | 22.2 KB 22.2 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| FSC (解像度算出) |  emd_12073_fsc.xml emd_12073_fsc.xml | 11.3 KB | 表示 |  FSCデータファイル FSCデータファイル |
| 画像 |  emd_12073.png emd_12073.png | 227.1 KB | ||
| マスクデータ |  emd_12073_msk_1.map emd_12073_msk_1.map | 125 MB |  マスクマップ マスクマップ | |
| その他 |  emd_12073_half_map_1.map.gz emd_12073_half_map_1.map.gz emd_12073_half_map_2.map.gz emd_12073_half_map_2.map.gz | 106.5 MB 106.5 MB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-12073 http://ftp.pdbj.org/pub/emdb/structures/EMD-12073 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12073 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-12073 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_12073_validation.pdf.gz emd_12073_validation.pdf.gz | 473.9 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_12073_full_validation.pdf.gz emd_12073_full_validation.pdf.gz | 473.4 KB | 表示 | |
| XML形式データ |  emd_12073_validation.xml.gz emd_12073_validation.xml.gz | 19.5 KB | 表示 | |
| CIF形式データ |  emd_12073_validation.cif.gz emd_12073_validation.cif.gz | 25.2 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12073 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12073 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12073 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-12073 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_12073.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_12073.map.gz / 形式: CCP4 / 大きさ: 125 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 注釈 | human Thyroglobulin, composite map | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ボクセルのサイズ | X=Y=Z: 1.28 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
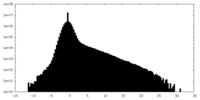
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
-マスク #1
| ファイル |  emd_12073_msk_1.map emd_12073_msk_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
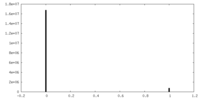
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #2
| ファイル | emd_12073_half_map_1.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
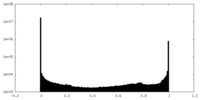
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
-ハーフマップ: #1
| ファイル | emd_12073_half_map_2.map | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
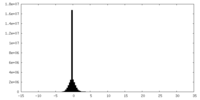
| 投影像・断面図 |
| ||||||||||||
| 密度ヒストグラム |
- 試料の構成要素
試料の構成要素
-全体 : human thyroglobulin
| 全体 | 名称: human thyroglobulin |
|---|---|
| 要素 |
|
-超分子 #1: human thyroglobulin
| 超分子 | 名称: human thyroglobulin / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 詳細: human thyroglobulin purified from thyroid gland tissue and non in vitro iodinated |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) / 器官: Thyroid / 組織: Thyroid Homo sapiens (ヒト) / 器官: Thyroid / 組織: Thyroid |
| 分子量 | 理論値: 660 KDa |
-分子 #1: Thyroglobulin
| 分子 | 名称: Thyroglobulin / タイプ: protein_or_peptide / ID: 1 / コピー数: 2 / 光学異性体: LEVO |
|---|---|
| 由来(天然) | 生物種:  Human (ヒト) / 器官: Thyroid / 組織: Thyroid Human (ヒト) / 器官: Thyroid / 組織: Thyroid |
| 分子量 | 理論値: 305.069844 KDa |
| 配列 | 文字列: MALVLEIFTL LASICWVSAN IFEYQVDAQP LRPCELQRET AFLKQADYVP QCAEDGSFQT VQCQNDGRSC WCVGANGSEV LGSRQPGRP VACLSFCQLQ KQQILLSGYI NSTDTSYLPQ CQDSGDYAPV QCDVQQVQCW CVDAEGMEVY GTRQLGRPKR C PRSCEIRN ...文字列: MALVLEIFTL LASICWVSAN IFEYQVDAQP LRPCELQRET AFLKQADYVP QCAEDGSFQT VQCQNDGRSC WCVGANGSEV LGSRQPGRP VACLSFCQLQ KQQILLSGYI NSTDTSYLPQ CQDSGDYAPV QCDVQQVQCW CVDAEGMEVY GTRQLGRPKR C PRSCEIRN RRLLHGVGDK SPPQCSAEGE FMPVQCKFVN TTDMMIFDLV HSYNRFPDAF VTFSSFQRRF PEVSGYCHCA DS QGRELAE TGLELLLDEI YDTIFAGLDL PSTFTETTLY RILQRRFLAV QSVISGRFRC PTKCEVERFT ATSFGHPYVP SCR RNGDYQ AVQCQTEGPC WCVDAQGKEM HGTRQQGEPP SCAEGQSCAS ERQQALSRLY FGTSGYFSQH DLFSSPEKRW ASPR VARFA TSCPPTIKEL FVDSGLLRPM VEGQSQQFSV SENLLKEAIR AIFPSRGLAR LALQFTTNPK RLQQNLFGGK FLVNV GQFN LSGALGTRGT FNFSQFFQQL GLASFLNGGR QEDLAKPLSV GLDSNSSTGT PEAAKKDGTM NKPTVGSFGF EINLQE NQN ALKFLASLLE LPEFLLFLQH AISVPEDVAR DLGDVMETVL SSQTCEQTPE RLFVPSCTTE GSYEDVQCFS GECWCVN SW GKELPGSRVR GGQPRCPTDC EKQRARMQSL MGSQPAGSTL FVPACTSEGH FLPVQCFNSE CYCVDAEGQA IPGTRSAI G KPKKCPTPCQ LQSEQAFLRT VQALLSNSSM LPTLSDTYIP QCSTDGQWRQ VQCNGPPEQV FELYQRWEAQ NKGQDLTPA KLLVKIMSYR EAASGNFSLF IQSLYEAGQQ DVFPVLSQYP SLQDVPLAAL EGKRPQPREN ILLEPYLFWQ ILNGQLSQYP GSYSDFSTP LAHFDLRNCW CVDEAGQELE GMRSEPSKLP TCPGSCEEAK LRVLQFIRET EEIVSASNSS RFPLGESFLV A KGIRLRNE DLGLPPLFPP REAFAEQFLR GSDYAIRLAA QSTLSFYQRR RFSPDDSAGA SALLRSGPYM PQCDAFGSWE PV QCHAGTG HCWCVDEKGG FIPGSLTARS LQIPQCPTTC EKSRTSGLLS SWKQARSQEN PSPKDLFVPA CLETGEYARL QAS GAGTWC VDPASGEELR PGSSSSAQCP SLCNVLKSGV LSRRVSPGYV PACRAEDGGF SPVQCDQAQG SCWCVMDSGE EVPG TRVTG GQPACESPRC PLPFNASEVV GGTILCETIS GPTGSAMQQC QLLCRQGSWS VFPPGPLICS LESGRWESQL PQPRA CQRP QLWQTIQTQG HFQLQLPPGK MCSADYADLL QTFQVFILDE LTARGFCQIQ VKTFGTLVSI PVCNNSSVQV GCLTRE RLG VNVTWKSRLE DIPVASLPDL HDIERALVGK DLLGRFTDLI QSGSFQLHLD SKTFPAETIR FLQGDHFGTS PRTWFGC SE GFYQVLTSEA SQDGLGCVKC PEGSYSQDEE CIPCPVGFYQ EQAGSLACVP CPVGRTTISA GAFSQTHCVT DCQRNEAG L QCDQNGQYRA SQKDRGSGKA FCVDGEGRRL PWWETEAPLE DSQCLMMQKF EKVPESKVIF DANAPVAVRS KVPDSEFPV MQCLTDCTED EACSFFTVST TEPEISCDFY AWTSDNVACM TSDQKRDALG NSKATSFGSL RCQVKVRSHG QDSPAVYLKK GQGSTTTLQ KRFEPTGFQN MLSGLYNPIV FSASGANLTD AHLFCLLACD RDLCCDGFVL TQVQGGAIIC GLLSSPSVLL C NVKDWMDP SEAWANATCP GVTYDQESHQ VILRLGDQEF IKSLTPLEGT QDTFTNFQQV YLWKDSDMGS RPESMGCRKD TV PRPASPT EAGLTTELFS PVDLNQVIVN GNQSLSSQKH WLFKHLFSAQ QANLWCLSRC VQEHSFCQLA EITESASLYF TCT LYPEAQ VCDDIMESNA QGCRLILPQM PKALFRKKVI LEDKVKNFYT RLPFQKLMGI SIRNKVPMSE KSISNGFFEC ERRC DADPC CTGFGFLNVS QLKGGEVTCL TLNSLGIQMC SEENGGAWRI LDCGSPDIEV HTYPFGWYQK PIAQNNAPSF CPLVV LPSL TEKVSLDSWQ SLALSSVVVD PSIRHFDVAH VSTAATSNFS AVRDLCLSEC SQHEACLITT LQTQPGAVRC MFYADT QSC THSLQGQNCR LLLREEATHI YRKPGISLLS YEASVPSVPI STHGRLLGRS QAIQVGTSWK QVDQFLGVPY AAPPLAE RR FQAPEPLNWT GSWDASKPRA SCWQPGTRTS TSPGVSEDCL YLNVFIPQNV APNASVLVFF HNTMDREESE GWPAIDGS F LAAVGNLIVV TASYRVGVFG FLSSGSGEVS GNWGLLDQVA ALTWVQTHIR GFGGDPRRVS LAADRGGADV ASIHLLTAR ATNSQLFRRA VLMGGSALSP AAVISHERAQ QQAIALAKEV SCPMSSSQEV VSCLRQKPAN VLNDAQTKLL AVSGPFHYWG PVIDGHFLR EPPARALKRS LWVEVDLLIG SSQDDGLINR AKAVKQFEES RGRTSSKTAF YQALQNSLGG EDSDARVEAA A TWYYSLEH STDDYASFSR ALENATRDYF IICPIIDMAS AWAKRARGNV FMYHAPENYG HGSLELLADV QFALGLPFYP AY EGQFSLE EKSLSLKIMQ YFSHFIRSGN PNYPYEFSRK VPTFATPWPD FVPRAGGENY KEFSELLPNR QGLKKADCSF WSK YISSLK TSADGAKGGQ SAESEEEELT AGSGLREDLL SLQEPGSKTY SK |
-分子 #6: 2-acetamido-2-deoxy-beta-D-glucopyranose
| 分子 | 名称: 2-acetamido-2-deoxy-beta-D-glucopyranose / タイプ: ligand / ID: 6 / コピー数: 16 / 式: NAG |
|---|---|
| 分子量 | 理論値: 221.208 Da |
| Chemical component information |  ChemComp-NAG: |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | 単粒子再構成法 |
| 試料の集合状態 | particle |
- 試料調製
試料調製
| 濃度 | 2 mg/mL | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 緩衝液 | pH: 7.5 構成要素:
詳細: 0.22 um filtered and degased | ||||||||||||
| グリッド | モデル: Quantifoil R2/2 / 材質: COPPER / メッシュ: 400 / 支持フィルム - 材質: CARBON / 支持フィルム - トポロジー: HOLEY / 支持フィルム - Film thickness: 12.0 nm / 前処理 - タイプ: GLOW DISCHARGE / 前処理 - 雰囲気: AIR | ||||||||||||
| 凍結 | 凍結剤: ETHANE / チャンバー内湿度: 80 % / チャンバー内温度: 293.15 K / 装置: LEICA EM GP | ||||||||||||
| 詳細 | concentrated SEC peak |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | TFS KRIOS |
|---|---|
| 温度 | 最低: 80.0 K / 最高: 80.0 K |
| 特殊光学系 | エネルギーフィルター - 名称: GIF Quantum LS / エネルギーフィルター - スリット幅: 20 eV |
| 撮影 | フィルム・検出器のモデル: GATAN K2 SUMMIT (4k x 4k) 検出モード: COUNTING / デジタル化 - サイズ - 横: 3838 pixel / デジタル化 - サイズ - 縦: 3710 pixel / デジタル化 - サンプリング間隔: 5.0 µm / デジタル化 - 画像ごとのフレーム数: 1-50 / 撮影したグリッド数: 1 / 実像数: 8119 / 平均露光時間: 10.0 sec. / 平均電子線量: 50.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | C2レンズ絞り径: 70.0 µm / 倍率(補正後): 78125 / 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD / Cs: 2.7 mm / 最大 デフォーカス(公称値): 2.5 µm / 最小 デフォーカス(公称値): 0.5 µm / 倍率(公称値): 215000 |
| 試料ステージ | 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER ホルダー冷却材: NITROGEN |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
+ 画像解析
画像解析
-原子モデル構築 1
| 精密化 | プロトコル: AB INITIO MODEL |
|---|---|
| 得られたモデル |  PDB-7b75: |
 ムービー
ムービー コントローラー
コントローラー










 Z
Z Y
Y X
X