[日本語] English
 万見
万見- EMDB-11932: CryoEM structure of the super-constricted two-start dynamin 1 filament -
+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: EMDB / ID: EMD-11932 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| タイトル | CryoEM structure of the super-constricted two-start dynamin 1 filament | |||||||||
 マップデータ マップデータ | ||||||||||
 試料 試料 |
| |||||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報clathrin coat assembly involved in endocytosis / vesicle scission / synaptic vesicle budding from presynaptic endocytic zone membrane / presynaptic endocytic zone membrane / dynamin GTPase / chromaffin granule / regulation of vesicle size / Toll Like Receptor 4 (TLR4) Cascade / Retrograde neurotrophin signalling / Formation of annular gap junctions ...clathrin coat assembly involved in endocytosis / vesicle scission / synaptic vesicle budding from presynaptic endocytic zone membrane / presynaptic endocytic zone membrane / dynamin GTPase / chromaffin granule / regulation of vesicle size / Toll Like Receptor 4 (TLR4) Cascade / Retrograde neurotrophin signalling / Formation of annular gap junctions / endosome organization / Gap junction degradation / photoreceptor ribbon synapse / membrane coat / Recycling pathway of L1 / phosphatidylinositol-3,4,5-trisphosphate binding / endocytic vesicle / EPH-ephrin mediated repulsion of cells / clathrin-coated pit / phosphatidylinositol-4,5-bisphosphate binding / MHC class II antigen presentation / photoreceptor inner segment / receptor-mediated endocytosis / cell projection / modulation of chemical synaptic transmission / protein homooligomerization / receptor internalization / endocytosis / GDP binding / : / presynapse / Clathrin-mediated endocytosis / microtubule binding / protein homotetramerization / microtubule / GTPase activity / glutamatergic synapse / synapse / GTP binding / protein kinase binding / protein homodimerization activity / RNA binding / extracellular exosome / identical protein binding / plasma membrane / cytoplasm 類似検索 - 分子機能 | |||||||||
| 生物種 |  Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||
| 手法 | らせん対称体再構成法 / クライオ電子顕微鏡法 / 解像度: 3.74 Å | |||||||||
 データ登録者 データ登録者 | Liu JW / Zhang PJ | |||||||||
| 資金援助 |  英国, 1件 英国, 1件
| |||||||||
 引用 引用 |  ジャーナル: Nat Commun / 年: 2021 ジャーナル: Nat Commun / 年: 2021タイトル: CryoEM structure of the super-constricted two-start dynamin 1 filament. 著者: Jiwei Liu / Frances Joan D Alvarez / Daniel K Clare / Jeffrey K Noel / Peijun Zhang /    要旨: Dynamin belongs to the large GTPase superfamily, and mediates the fission of vesicles during endocytosis. Dynamin molecules are recruited to the neck of budding vesicles to assemble into a helical ...Dynamin belongs to the large GTPase superfamily, and mediates the fission of vesicles during endocytosis. Dynamin molecules are recruited to the neck of budding vesicles to assemble into a helical collar and to constrict the underlying membrane. Two helical forms were observed: the one-start helix in the constricted state and the two-start helix in the super-constricted state. Here we report the cryoEM structure of a super-constricted two-start dynamin 1 filament at 3.74 Å resolution. The two strands are joined by the conserved GTPase dimeric interface. In comparison with the one-start structure, a rotation around Hinge 1 is observed, essential for communicating the chemical power of the GTPase domain and the mechanical force of the Stalk and PH domain onto the underlying membrane. The Stalk interfaces are well conserved and serve as fulcrums for adapting to changing curvatures. Relative to one-start, small rotations per interface accumulate to bring a drastic change in the helical pitch. Elasticity theory rationalizes the diversity of dynamin helical symmetries and suggests corresponding functional significance. | |||||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | EMマップ:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| 添付画像 |
- ダウンロードとリンク
ダウンロードとリンク
-EMDBアーカイブ
| マップデータ |  emd_11932.map.gz emd_11932.map.gz | 43.2 MB |  EMDBマップデータ形式 EMDBマップデータ形式 | |
|---|---|---|---|---|
| ヘッダ (付随情報) |  emd-11932-v30.xml emd-11932-v30.xml emd-11932.xml emd-11932.xml | 10.3 KB 10.3 KB | 表示 表示 |  EMDBヘッダ EMDBヘッダ |
| 画像 |  emd_11932.png emd_11932.png | 124.1 KB | ||
| アーカイブディレクトリ |  http://ftp.pdbj.org/pub/emdb/structures/EMD-11932 http://ftp.pdbj.org/pub/emdb/structures/EMD-11932 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11932 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-11932 | HTTPS FTP |
-検証レポート
| 文書・要旨 |  emd_11932_validation.pdf.gz emd_11932_validation.pdf.gz | 335.4 KB | 表示 |  EMDB検証レポート EMDB検証レポート |
|---|---|---|---|---|
| 文書・詳細版 |  emd_11932_full_validation.pdf.gz emd_11932_full_validation.pdf.gz | 335 KB | 表示 | |
| XML形式データ |  emd_11932_validation.xml.gz emd_11932_validation.xml.gz | 7.8 KB | 表示 | |
| CIF形式データ |  emd_11932_validation.cif.gz emd_11932_validation.cif.gz | 9 KB | 表示 | |
| アーカイブディレクトリ |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11932 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11932 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11932 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-11932 | HTTPS FTP |
-関連構造データ
- リンク
リンク
| EMDBのページ |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| 「今月の分子」の関連する項目 |
- マップ
マップ
| ファイル |  ダウンロード / ファイル: emd_11932.map.gz / 形式: CCP4 / 大きさ: 506 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) ダウンロード / ファイル: emd_11932.map.gz / 形式: CCP4 / 大きさ: 506 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ボクセルのサイズ | X=Y=Z: 1.048 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 対称性 | 空間群: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細 | EMDB XML:
CCP4マップ ヘッダ情報:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-添付データ
- 試料の構成要素
試料の構成要素
-全体 : dynamin 1
| 全体 | 名称: dynamin 1 |
|---|---|
| 要素 |
|
-超分子 #1: dynamin 1
| 超分子 | 名称: dynamin 1 / タイプ: complex / ID: 1 / 親要素: 0 / 含まれる分子: #1 |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
-分子 #1: Dynamin-1
| 分子 | 名称: Dynamin-1 / タイプ: protein_or_peptide / ID: 1 / コピー数: 36 / 光学異性体: LEVO / EC番号: dynamin GTPase |
|---|---|
| 由来(天然) | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 分子量 | 理論値: 97.536359 KDa |
| 組換発現 | 生物種:  Homo sapiens (ヒト) Homo sapiens (ヒト) |
| 配列 | 文字列: MGNRGMEDLI PLVNRLQDAF SAIGQNADLD LPQIAVVGGQ SAGKSSVLEN FVGRDFLPRG SGIVTRRPLV LQLVNATTEY AEFLHCKGK KFTDFEEVRL EIEAETDRVT GTNKGISPVP INLRVYSPHV LNLTLVDLPG MTKVPVGDQP PDIEFQIRDM L MQFVTKEN ...文字列: MGNRGMEDLI PLVNRLQDAF SAIGQNADLD LPQIAVVGGQ SAGKSSVLEN FVGRDFLPRG SGIVTRRPLV LQLVNATTEY AEFLHCKGK KFTDFEEVRL EIEAETDRVT GTNKGISPVP INLRVYSPHV LNLTLVDLPG MTKVPVGDQP PDIEFQIRDM L MQFVTKEN CLILAVSPAN SDLANSDALK VAKEVDPQGQ RTIGVITKLD LMDEGTDARD VLENKLLPLR RGYIGVVNRS QK DIDGKKD ITAALAAERK FFLSHPSYRH LADRMGTPYL QKVLNQQLTN HIRDTLPGLR NKLQSQLLSI EKEVEEYKNF RPD DPARKT KALLQMVQQF AVDFEKRIEG SGDQIDTYEL SGGARINRIF HERFPFELVK MEFDEKELRR EISYAIKNIH GIRT GLFTP DMAFETIVKK QVKKIREPCL KCVDMVISEL ISTVRQCTKK LQQYPRLREE MERIVTTHIR EREGRTKEQV MLLID IELA YMNTNHEDFI GFANAQQRSN QMNKKKTSGN QDEILVIRKG WLTINNIGIM KGGSKEYWFV LTAENLSWYK DDEEKE KKY MLSVDNLKLR DVEKGFMSSK HIFALFNTEQ RNVYKDYRQL ELACETQEEV DSWKASFLRA GVYPERVGDK EKASETE EN GSDSFMHSMD PQLERQVETI RNLVDSYMAI VNKTVRDLMP KTIMHLMINN TKEFIFSELL ANLYSCGDQN TLMEESAE Q AQRRDEMLRM YHALKEALSI IGNINTTTVS TPMPPPVDDS WLQVQSVPAG RRSPTSSPTP QRRAPAVPPA RPGSRGPAP GPPPAGSALG GAPPVPSRPG ASPDPFGPPP QVPSRPNRAP PGVPSRSGQA SPSRPESPRP PFDL |
-分子 #2: PHOSPHOMETHYLPHOSPHONIC ACID GUANYLATE ESTER
| 分子 | 名称: PHOSPHOMETHYLPHOSPHONIC ACID GUANYLATE ESTER / タイプ: ligand / ID: 2 / コピー数: 36 / 式: GCP |
|---|---|
| 分子量 | 理論値: 521.208 Da |
| Chemical component information | 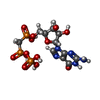 ChemComp-G2P: |
-分子 #3: MAGNESIUM ION
| 分子 | 名称: MAGNESIUM ION / タイプ: ligand / ID: 3 / コピー数: 36 / 式: MG |
|---|---|
| 分子量 | 理論値: 24.305 Da |
-実験情報
-構造解析
| 手法 | クライオ電子顕微鏡法 |
|---|---|
 解析 解析 | らせん対称体再構成法 |
| 試料の集合状態 | helical array |
- 試料調製
試料調製
| 緩衝液 | pH: 7 |
|---|---|
| 凍結 | 凍結剤: ETHANE |
- 電子顕微鏡法
電子顕微鏡法
| 顕微鏡 | FEI TITAN KRIOS |
|---|---|
| 撮影 | フィルム・検出器のモデル: GATAN K2 QUANTUM (4k x 4k) 平均電子線量: 45.0 e/Å2 |
| 電子線 | 加速電圧: 300 kV / 電子線源:  FIELD EMISSION GUN FIELD EMISSION GUN |
| 電子光学系 | 照射モード: FLOOD BEAM / 撮影モード: BRIGHT FIELD |
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
- 画像解析
画像解析
| 最終 再構成 | 想定した対称性 - らせんパラメータ - Δz: 13.58 Å 想定した対称性 - らせんパラメータ - ΔΦ: 24.43 ° 想定した対称性 - らせんパラメータ - 軸対称性: C2 (2回回転対称) 解像度のタイプ: BY AUTHOR / 解像度: 3.74 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 使用した粒子像数: 16772 |
|---|---|
| 最終 角度割当 | タイプ: NOT APPLICABLE |
 ムービー
ムービー コントローラー
コントローラー























