+検索条件
-Structure paper
| タイトル | Propofol rescues voltage-dependent gating of HCN1 channel epilepsy mutants. |
|---|---|
| ジャーナル・号・ページ | Nature, Vol. 632, Issue 8024, Page 451-459, Year 2024 |
| 掲載日 | 2024年7月31日 |
 著者 著者 | Elizabeth D Kim / Xiaoan Wu / Sangyun Lee / Gareth R Tibbs / Kevin P Cunningham / Eleonora Di Zanni / Marta E Perez / Peter A Goldstein / Alessio Accardi / H Peter Larsson / Crina M Nimigean /    |
| PubMed 要旨 | Hyperpolarization-activated cyclic nucleotide-gated (HCN) channels are essential for pacemaking activity and neural signalling. Drugs inhibiting HCN1 are promising candidates for management of ...Hyperpolarization-activated cyclic nucleotide-gated (HCN) channels are essential for pacemaking activity and neural signalling. Drugs inhibiting HCN1 are promising candidates for management of neuropathic pain and epileptic seizures. The general anaesthetic propofol (2,6-di-iso-propylphenol) is a known HCN1 allosteric inhibitor with unknown structural basis. Here, using single-particle cryo-electron microscopy and electrophysiology, we show that propofol inhibits HCN1 by binding to a mechanistic hotspot in a groove between the S5 and S6 transmembrane helices. We found that propofol restored voltage-dependent closing in two HCN1 epilepsy-associated polymorphisms that act by destabilizing the channel closed state: M305L, located in the propofol-binding site in S5, and D401H in S6 (refs. ). To understand the mechanism of propofol inhibition and restoration of voltage-gating, we tracked voltage-sensor movement in spHCN channels and found that propofol inhibition is independent of voltage-sensor conformational changes. Mutations at the homologous methionine in spHCN and an adjacent conserved phenylalanine in S6 similarly destabilize closing without disrupting voltage-sensor movements, indicating that voltage-dependent closure requires this interface intact. We propose a model for voltage-dependent gating in which propofol stabilizes coupling between the voltage sensor and pore at this conserved methionine-phenylalanine interface in HCN channels. These findings unlock potential exploitation of this site to design specific drugs targeting HCN channelopathies. |
 リンク リンク |  Nature / Nature /  PubMed:39085604 PubMed:39085604 |
| 手法 | EM (単粒子) |
| 解像度 | 2.5 - 3.3 Å |
| 構造データ | EMDB-42116, PDB-8uc7: EMDB-42117, PDB-8uc8: EMDB-44425, PDB-9bc6: EMDB-44426, PDB-9bc7: |
| 化合物 | 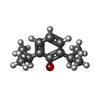 ChemComp-PFL:  ChemComp-PCW: 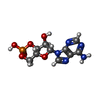 ChemComp-CMP: |
| 由来 |
|
 キーワード キーワード | TRANSPORT PROTEIN/INHIBITOR / inhibitor / complex / plasma membrane / cyclic nucleotide / TRANSPORT PROTEIN-INHIBITOR complex / TRANSPORT PROTEIN / membrane protein / nanodisc |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について










 homo sapiens (ヒト)
homo sapiens (ヒト)