+検索条件
-Structure paper
| タイトル | An Analysis of the Novel Fluorocycline TP-6076 Bound to Both the Ribosome and Multidrug Efflux Pump AdeJ from Acinetobacter baumannii. |
|---|---|
| ジャーナル・号・ページ | mBio, Vol. 13, Issue 1, Page e0373221, Year 2021 |
| 掲載日 | 2021年2月22日 |
 著者 著者 | Christopher E Morgan / Zhemin Zhang / Robert A Bonomo / Edward W Yu /  |
| PubMed 要旨 | Antibiotic resistance among bacterial pathogens continues to pose a serious global health threat. Multidrug-resistant (MDR) strains of the Gram-negative organism Acinetobacter baumannii utilize a ...Antibiotic resistance among bacterial pathogens continues to pose a serious global health threat. Multidrug-resistant (MDR) strains of the Gram-negative organism Acinetobacter baumannii utilize a number of resistance determinants to evade current antibiotics. One of the major resistance mechanisms employed by these pathogens is the use of multidrug efflux pumps. These pumps extrude xenobiotics directly out of bacterial cells, resulting in treatment failures when common antibiotics are administered. Here, the structure of the novel tetracycline antibiotic TP-6076, bound to both the cinetobacter rug fflux pump AdeJ and the ribosome from Acinetobacter baumannii, using single-particle cryo-electron microscopy (cryo-EM), is elucidated. In this work, the structure of the AdeJ-TP-6076 complex is solved, and we show that AdeJ utilizes a network of hydrophobic interactions to recognize this fluorocycline. Concomitant with this, we elucidate three structures of TP-6076 bound to the A. baumannii ribosome and determine that its binding is stabilized largely by electrostatic interactions. We then compare the differences in binding modes between TP-6076 and the related tetracycline antibiotic eravacycline in both targets. These differences suggest that modifications to the tetracycline core may be able to alter AdeJ binding while maintaining interactions with the ribosome. Together, this work highlights how different mechanisms are used to stabilize the binding of tetracycline-based compounds to unique bacterial targets and provides guidance for the future clinical development of tetracycline antibiotics. Treatment of antibiotic-resistant organisms such as A. baumannii represents an ongoing issue for modern medicine. The multidrug efflux pump AdeJ serves as a major resistance determinant in A. baumannii through its action of extruding antibiotics from the cell. In this work, we use cryo-EM to show how AdeJ recognizes the experimental tetracycline antibiotic TP-6076 and prevents this drug from interacting with the A. baumannii ribosome. Since AdeJ and the ribosome use different binding modes to stabilize interactions with TP-6076, exploiting these differences may guide future drug development for combating antibiotic-resistant A. baumannii and potentially other strains of MDR bacteria. |
 リンク リンク |  mBio / mBio /  PubMed:35100868 / PubMed:35100868 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 2.38 - 2.91 Å |
| 構造データ | EMDB-24732, PDB-7ry3: EMDB-24738, PDB-7ryf: EMDB-24739, PDB-7ryg: EMDB-24740, PDB-7ryh: |
| 化合物 | 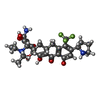 ChemComp-80P:  ChemComp-ZN:  ChemComp-MG: |
| 由来 |
|
 キーワード キーワード | MEMBRANE PROTEIN/ANTIBIOTIC / multidrug efflux pump / MEMBRANE PROTEIN-ANTIBIOTIC complex / Ribosome/RNA / Antibiotic / Ribosome / tetracycline / Ribosome-RNA complex |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について











 acinetobacter baumannii (バクテリア)
acinetobacter baumannii (バクテリア)