+検索条件
-Structure paper
| タイトル | Molecular comparison of Neanderthal and Modern Human adenylosuccinate lyase. |
|---|---|
| ジャーナル・号・ページ | Sci Rep, Vol. 8, Issue 1, Page 18008, Year 2018 |
| 掲載日 | 2018年12月20日 |
 著者 著者 | Bart Van Laer / Ulrike Kapp / Montserrat Soler-Lopez / Kaja Moczulska / Svante Pääbo / Gordon Leonard / Christoph Mueller-Dieckmann /    |
| PubMed 要旨 | The availability of genomic data from extinct homini such as Neanderthals has caused a revolution in palaeontology allowing the identification of modern human-specific protein substitutions. ...The availability of genomic data from extinct homini such as Neanderthals has caused a revolution in palaeontology allowing the identification of modern human-specific protein substitutions. Currently, little is known as to how these substitutions alter the proteins on a molecular level. Here, we investigate adenylosuccinate lyase, a conserved enzyme involved in purine metabolism for which several substitutions in the modern human protein (hADSL) have been described to affect intelligence and behaviour. During evolution, modern humans acquired a specific substitution (Ala429Val) in ADSL distinguishing it from the ancestral variant present in Neanderthals (nADSL). We show here that despite this conservative substitution being solvent exposed and located distant from the active site, there is a difference in thermal stability, but not enzymology or ligand binding between nADSL and hADSL. Substitutions near residue 429 which do not profoundly affect enzymology were previously reported to cause neurological symptoms in humans. This study also reveals that ADSL undergoes conformational changes during catalysis which, together with the crystal structure of a hitherto undetermined product bound conformation, explains the molecular origin of disease for several modern human ADSL mutants. |
 リンク リンク |  Sci Rep / Sci Rep /  PubMed:30573755 / PubMed:30573755 /  PubMed Central PubMed Central |
| 手法 | SAS (X-ray synchrotron) / X線回折 |
| 解像度 | 1.7 - 2.4 Å |
| 構造データ | 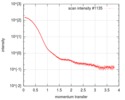 SASDEG5: apo human adenylosuccinate lyase (ADSL) (Adenylosuccinate Lyase, ADSL)  SASDEH5: AMP/fumarate-bound human adenylosuccinate lyase (ADSL) 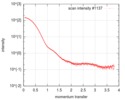 SASDEJ5: AICAR/fumarate-bound human adenylosuccinate lyase (ADSL)  SASDEK5: AMP-bound human adenylosuccinate lyase (ADSL) (Adenylosuccinate Lyase, ADSL) 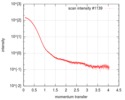 SASDEL5: AICAR-bound human adenylosuccinate lyase (ADSL) (Adenylosuccinate Lyase, ADSL)  SASDEM5:  SASDEN5: 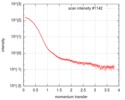 SASDEP5: AMP-bound neanderthal adenylosuccinate lyase (ADSL)  SASDEQ5: AICAR-bound neanderthal adenylosuccinate lyase (ADSL)  SASDER5:  PDB-5nx8:  PDB-5nx9:  PDB-5nxa: |
| 化合物 |  ChemComp-PEG:  ChemComp-GOL:  ChemComp-CL:  ChemComp-HOH:  ChemComp-AMP: 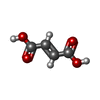 ChemComp-FUM:  ChemComp-2SA: 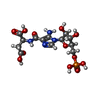 ChemComp-SSS:  ChemComp-AMZ: |
| 由来 |
|
 キーワード キーワード | LYASE / Adenylosuccinate Lyase / fumarase |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について



 Homo sapiens (ヒト)
Homo sapiens (ヒト)