+検索条件
-Structure paper
| タイトル | Distinct structural features of cyclothiazide are responsible for effects on peak current amplitude and desensitization kinetics at iGluR2. |
|---|---|
| ジャーナル・号・ページ | J. Mol. Biol., Vol. 391, Page 906-917, Year 2009 |
| 掲載日 | 2009年4月24日 (構造データの登録日) |
 著者 著者 | Hald, H. / Ahring, P.K. / Timmermann, D.B. / Liljefors, T. / Gajhede, M. / Kastrup, J.S. |
 リンク リンク |  J. Mol. Biol. / J. Mol. Biol. /  PubMed:19591837 PubMed:19591837 |
| 手法 | X線回折 |
| 解像度 | 1.49 - 2.25 Å |
| 構造データ |  PDB-3h6t:  PDB-3h6u:  PDB-3h6v:  PDB-3h6w: |
| 化合物 |  ChemComp-GLU:  ChemComp-ZN:  ChemComp-GOL:  ChemComp-ACT:  ChemComp-DMS: 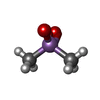 ChemComp-CAC:  ChemComp-HOH:  ChemComp-NS3:  ChemComp-SO4:  ChemComp-FLC:  ChemComp-NS6:  ChemComp-NS7: |
| 由来 |
|
 キーワード キーワード | MEMBRANE PROTEIN / AMPA receptor ligand-binding core / iGluR2 S1S2J-N754S / cyclothiazide / allosteric modulation / AMPA receptor ligand-bidning core |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について