+検索条件
-Structure paper
| タイトル | Calsyntenin-3 molecular architecture and interaction with neurexin 1α. |
|---|---|
| ジャーナル・号・ページ | J Biol Chem, Vol. 289, Issue 50, Page 34530-34542, Year 2014 |
| 掲載日 | 2014年12月12日 |
 著者 著者 | Zhuoyang Lu / Yun Wang / Fang Chen / Huimin Tong / M V V V Sekhar Reddy / Lin Luo / Suchithra Seshadrinathan / Lei Zhang / Luis Marcelo F Holthauzen / Ann Marie Craig / Gang Ren / Gabby Rudenko /    |
| PubMed 要旨 | Calsyntenin 3 (Cstn3 or Clstn3), a recently identified synaptic organizer, promotes the development of synapses. Cstn3 localizes to the postsynaptic membrane and triggers presynaptic differentiation. ...Calsyntenin 3 (Cstn3 or Clstn3), a recently identified synaptic organizer, promotes the development of synapses. Cstn3 localizes to the postsynaptic membrane and triggers presynaptic differentiation. Calsyntenin members play an evolutionarily conserved role in memory and learning. Cstn3 was recently shown in cell-based assays to interact with neurexin 1α (n1α), a synaptic organizer that is implicated in neuropsychiatric disease. Interaction would permit Cstn3 and n1α to form a trans-synaptic complex and promote synaptic differentiation. However, it is contentious whether Cstn3 binds n1α directly. To understand the structure and function of Cstn3, we determined its architecture by electron microscopy and delineated the interaction between Cstn3 and n1α biochemically and biophysically. We show that Cstn3 ectodomains form monomers as well as tetramers that are stabilized by disulfide bonds and Ca(2+), and both are probably flexible in solution. We show further that the extracellular domains of Cstn3 and n1α interact directly and that both Cstn3 monomers and tetramers bind n1α with nanomolar affinity. The interaction is promoted by Ca(2+) and requires minimally the LNS domain of Cstn3. Furthermore, Cstn3 uses a fundamentally different mechanism to bind n1α compared with other neurexin partners, such as the synaptic organizer neuroligin 2, because Cstn3 does not strictly require the sixth LNS domain of n1α. Our structural data suggest how Cstn3 as a synaptic organizer on the postsynaptic membrane, particularly in tetrameric form, may assemble radially symmetric trans-synaptic bridges with the presynaptic synaptic organizer n1α to recruit and spatially organize proteins into networks essential for synaptic function. |
 リンク リンク |  J Biol Chem / J Biol Chem /  PubMed:25352602 / PubMed:25352602 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 15.0 - 16.5 Å |
| 構造データ |  EMDB-6009:  EMDB-6010: 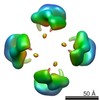 EMDB-6011: 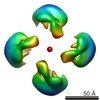 EMDB-6012: |
| 由来 |
|
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について



 Homo sapiens (ヒト)
Homo sapiens (ヒト)