+検索条件
-Structure paper
| タイトル | Allosteric competition and inhibition in AMPA receptors. |
|---|---|
| ジャーナル・号・ページ | Nat Struct Mol Biol, Year 2024 |
| 掲載日 | 2024年6月4日 |
 著者 著者 | W Dylan Hale / Alejandra Montaño Romero / Cuauhtemoc U Gonzalez / Vasanthi Jayaraman / Albert Y Lau / Richard L Huganir / Edward C Twomey /  |
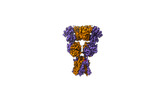
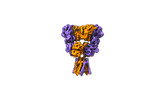
| PubMed 要旨 | Excitatory neurotransmission is principally mediated by α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA)-subtype ionotropic glutamate receptors (AMPARs). Negative allosteric modulators ...Excitatory neurotransmission is principally mediated by α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid (AMPA)-subtype ionotropic glutamate receptors (AMPARs). Negative allosteric modulators are therapeutic candidates that inhibit AMPAR activation and can compete with positive modulators to control AMPAR function through unresolved mechanisms. Here we show that allosteric inhibition pushes AMPARs into a distinct state that prevents both activation and positive allosteric modulation. We used cryo-electron microscopy to capture AMPARs bound to glutamate, while a negative allosteric modulator, GYKI-52466, and positive allosteric modulator, cyclothiazide, compete for control of the AMPARs. GYKI-52466 binds in the ion channel collar and inhibits AMPARs by decoupling the ligand-binding domains from the ion channel. The rearrangement of the ligand-binding domains ruptures the cyclothiazide site, preventing positive modulation. Our data provide a framework for understanding allostery of AMPARs and for rational design of therapeutics targeting AMPARs in neurological diseases. |
 リンク リンク |  Nat Struct Mol Biol / Nat Struct Mol Biol /  PubMed:38834914 PubMed:38834914 |
| 手法 | EM (単粒子) |
| 解像度 | 3.5 - 4.85 Å |
| 構造データ | EMDB-43275, PDB-8vj6: EMDB-43276, PDB-8vj7: |
| 化合物 |  PDB-1ab5:  ChemComp-GLU: |
| 由来 |
|
 キーワード キーワード | MEMBRANE PROTEIN/INHIBITOR / ligand gated ion channel / ionotropic glutamate receptor / allosteric inhibition / MEMBRANE PROTEIN / MEMBRANE PROTEIN-INHIBITOR complex |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について