+検索条件
-Structure paper
| タイトル | Cryo-EM structures of human arachidonate 12S-lipoxygenase bound to endogenous and exogenous inhibitors. |
|---|---|
| ジャーナル・号・ページ | Blood, Vol. 142, Issue 14, Page 1233-1242, Year 2023 |
| 掲載日 | 2023年7月28日 |
 著者 著者 | Jesse I Mobbs / Katrina A Black / Michelle Tran / Wessel A C Burger / Hariprasad Venugopal / Theodore R Holman / Michael Holinstat / David M Thal / Alisa Glukhova /   |
| PubMed 要旨 | Human 12-lipoxygenase (12-LOX) is a key enzyme involved in platelet activation, and the regulation of its activity has been targeted for the treatment of heparin-induced thrombocytopenia. Despite the ...Human 12-lipoxygenase (12-LOX) is a key enzyme involved in platelet activation, and the regulation of its activity has been targeted for the treatment of heparin-induced thrombocytopenia. Despite the clinical importance of 12-LOX, the exact mechanisms by which it affects platelet activation are not fully understood, and the lack of structural information has limited drug discovery efforts. In this study, we used single-particle cryo-electron microscopy to determine high-resolution structures (1.7-2.8 Å) of human 12-LOX. Our results showed that 12-LOX can exist in multiple oligomeric states, from monomer to hexamer, which may affect its catalytic activity and membrane association. We also identified different conformations within the 12-LOX dimer, which likely represent different time points in its catalytic cycle. Furthermore, we identified small molecules bound to 12-LOX. The active site of the 12-LOX tetramer was occupied by an endogenous 12-LOX inhibitor, a long-chain acyl coenzyme A. In addition, we found that the 12-LOX hexamer can simultaneously bind to arachidonic acid and ML355, a selective 12-LOX inhibitor that has passed a phase 1 clinical trial for the treatment of heparin-induced thrombocytopenia and received a fast-track designation by the Food and Drug Administration. Overall, our findings provide novel insights into the assembly of 12-LOX oligomers, their catalytic mechanism, and small molecule binding, paving the way for further drug development targeting the 12-LOX enzyme. |
 リンク リンク |  Blood / Blood /  PubMed:37506345 / PubMed:37506345 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 2.05 - 2.76 Å |
| 構造データ | EMDB-40039, PDB-8ghb: EMDB-40040, PDB-8ghc: EMDB-40041, PDB-8ghd: EMDB-40042, PDB-8ghe:  EMDB-40299: Consensus refinement of the h12-LOX in a dimeric form  EMDB-40300: The local refinement map of a "closed" subunit of a 12-LOX dimer  EMDB-40301: The local refinement map of an "open" subunit of a 12-LOX dimer  EMDB-40302: The consensus map of a 12-LOX hexamer  EMDB-40304: The local refinement map of a single subunit of a 12-LOX hexamer |
| 化合物 |  ChemComp-FE2:  ChemComp-ZR5: 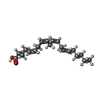 ChemComp-ACD:  ChemComp-3VV:  ChemComp-HOH: |
| 由来 |
|
 キーワード キーワード | OXIDOREDUCTASE / Lipoxygenase / platelets / lipid-modifying enzyme / lipid oxidation / OXIDOREDUCTASE/INHIBITOR / OXIDOREDUCTASE-INHIBITOR complex |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について











 homo sapiens (ヒト)
homo sapiens (ヒト)