+検索条件
-Structure paper
| タイトル | Adeno-associated Virus 9 Structural Rearrangements Induced by Endosomal Trafficking pH and Glycan Attachment. |
|---|---|
| ジャーナル・号・ページ | J Virol, Vol. 95, Issue 19, Page e0084321, Year 2021 |
| 掲載日 | 2021年9月9日 |
 著者 著者 | Judit J Penzes / Paul Chipman / Nilakshee Bhattacharya / Allison Zeher / Rick Huang / Robert McKenna / Mavis Agbandje-McKenna /  |
| PubMed 要旨 | Adeno-associated viruses (AAVs) are small nonenveloped single-stranded DNA (ssDNA) viruses that are currently being developed as gene therapy biologics. After cell entry, AAVs traffic to the nucleus ...Adeno-associated viruses (AAVs) are small nonenveloped single-stranded DNA (ssDNA) viruses that are currently being developed as gene therapy biologics. After cell entry, AAVs traffic to the nucleus using the endo-lysosomal pathway. The subsequent decrease in pH triggers conformational changes to the capsid that enable the externalization of the capsid protein (VP) N termini, including the unique domain of the minor capsid protein VP1 (VP1u), which permits the phospholipase activity required for the capsid lysosomal egress. Here, we report the AAV9 capsid structure, determined at the endosomal pHs (7.4, 6.0, 5.5, and 4.0), and terminal galactose-bound AAV9 capsids at pHs 7.4 and 5.5 using cryo-electron microscopy and three-dimensional image reconstruction. Taken together, these studies provide insight into AAV9 capsid conformational changes at the 5-fold pore during endosomal trafficking, in both the presence and absence of its cellular glycan receptor. We visualized, for the first time, that acidification induces the externalization of the VP3 and possibly VP2 N termini, presumably in prelude to the externalization of VP1u at pH 4.0, which is essential for lysosomal membrane disruption. In addition, the structural study of AAV9-galactose interactions demonstrates that AAV9 remains attached to its glycan receptor at the late endosome pH 5.5. This interaction significantly alters the conformational stability of the variable region I of the VPs, as well as the dynamics associated with VP N terminus externalization. There are 13 distinct Adeno-associated virus (AAV) serotypes that are structurally homologous and whose capsid proteins (VP1 to -3) are similar in amino acid sequence. However, AAV9 is one of the most commonly studied and is used as a gene therapy vector. This is partly because AAV9 is capable of crossing the blood-brain barrier and readily transduces a wide array of tissues, including the central nervous system. In this study, we provide AAV9 capsid structural insight during intracellular trafficking. Although the AAV capsid has been shown to externalize the N termini of its VPs, to enzymatically disrupt the lysosome membrane at low pH, there was no structural evidence to confirm this. By utilizing AAV9 as our model, we provide the first structural evidence that the externalization process occurs at the protein interface at the icosahedral 5-fold symmetry axis and can be triggered by lowering the pH. |
 リンク リンク |  J Virol / J Virol /  PubMed:34260280 / PubMed:34260280 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 2.43 - 2.99 Å |
| 構造データ | EMDB-23973, PDB-7mt0: EMDB-23986, PDB-7mtg: EMDB-23993, PDB-7mtp: EMDB-23999, PDB-7mtw: EMDB-24000, PDB-7mtz: EMDB-24003, PDB-7mua: |
| 化合物 | 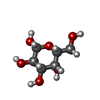 ChemComp-GAL: |
| 由来 |
|
 キーワード キーワード | VIRUS LIKE PARTICLE / adeno-associated virus / pH / phospholipase-A2 / capsid / gene therapy / AAV9 / dependoparvovirus / intracellular trafficking / endosome / galactose / glycan attachment |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について
















