+検索条件
-Structure paper
| タイトル | Nucleotide binding to the ATP-cone in anaerobic ribonucleotide reductases allosterically regulates activity by modulating substrate binding. |
|---|---|
| ジャーナル・号・ページ | Elife, Vol. 12, Year 2024 |
| 掲載日 | 2024年7月5日 |
 著者 著者 | Ornella Bimai / Ipsita Banerjee / Inna Rozman Grinberg / Ping Huang / Lucas Hultgren / Simon Ekström / Daniel Lundin / Britt-Marie Sjöberg / Derek T Logan /  |
| PubMed 要旨 | A small, nucleotide-binding domain, the ATP-cone, is found at the N-terminus of most ribonucleotide reductase (RNR) catalytic subunits. By binding adenosine triphosphate (ATP) or deoxyadenosine ...A small, nucleotide-binding domain, the ATP-cone, is found at the N-terminus of most ribonucleotide reductase (RNR) catalytic subunits. By binding adenosine triphosphate (ATP) or deoxyadenosine triphosphate (dATP) it regulates the enzyme activity of all classes of RNR. Functional and structural work on aerobic RNRs has revealed a plethora of ways in which dATP inhibits activity by inducing oligomerisation and preventing a productive radical transfer from one subunit to the active site in the other. Anaerobic RNRs, on the other hand, store a stable glycyl radical next to the active site and the basis for their dATP-dependent inhibition is completely unknown. We present biochemical, biophysical, and structural information on the effects of ATP and dATP binding to the anaerobic RNR from . The enzyme exists in a dimer-tetramer equilibrium biased towards dimers when two ATP molecules are bound to the ATP-cone and tetramers when two dATP molecules are bound. In the presence of ATP, NrdD is active and has a fully ordered glycyl radical domain (GRD) in one monomer of the dimer. Binding of dATP to the ATP-cone results in loss of activity and increased dynamics of the GRD, such that it cannot be detected in the cryo-EM structures. The glycyl radical is formed even in the dATP-bound form, but the substrate does not bind. The structures implicate a complex network of interactions in activity regulation that involve the GRD more than 30 Å away from the dATP molecules, the allosteric substrate specificity site and a conserved but previously unseen flap over the active site. Taken together, the results suggest that dATP inhibition in anaerobic RNRs acts by increasing the flexibility of the flap and GRD, thereby preventing both substrate binding and radical mobilisation. |
 リンク リンク |  Elife / Elife /  PubMed:38968292 / PubMed:38968292 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 2.4 - 3.17 Å |
| 構造データ | EMDB-17357, PDB-8p23: EMDB-17358, PDB-8p27: EMDB-17359, PDB-8p28: EMDB-17360, PDB-8p2c: EMDB-17361, PDB-8p2d: EMDB-17373, PDB-8p2s: EMDB-17385, PDB-8p39: |
| 化合物 |  ChemComp-ATP: 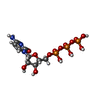 ChemComp-CTP:  ChemComp-ZN: 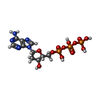 ChemComp-DTP:  ChemComp-MG:  ChemComp-TTP:  ChemComp-GTP: 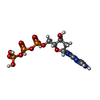 ChemComp-DGT: |
| 由来 |
|
 キーワード キーワード | BIOSYNTHETIC PROTEIN / ribonucleotide reductase glycyl radical enzyme allosteric regulation nucleotide biosynthesis / ribonucleotide reductase / glycyl radical enzyme / allosteric regulation / nucleotide biosynthesis / oxidoreductase |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について

















 prevotella copri (バクテリア)
prevotella copri (バクテリア)