+検索条件
-Structure paper
| タイトル | Sterol derivative binding to the orthosteric site causes conformational changes in an invertebrate Cys-loop receptor. |
|---|---|
| ジャーナル・号・ページ | Elife, Vol. 12, Year 2023 |
| 掲載日 | 2023年7月3日 |
 著者 著者 | Steven De Gieter / Casey I Gallagher / Eveline Wijckmans / Diletta Pasini / Chris Ulens / Rouslan G Efremov /  |
| PubMed 要旨 | Cys-loop receptors or pentameric ligand-gated ion channels are mediators of electrochemical signaling throughout the animal kingdom. Because of their critical function in neurotransmission and high ...Cys-loop receptors or pentameric ligand-gated ion channels are mediators of electrochemical signaling throughout the animal kingdom. Because of their critical function in neurotransmission and high potential as drug targets, Cys-loop receptors from humans and closely related organisms have been thoroughly investigated, whereas molecular mechanisms of neurotransmission in invertebrates are less understood. When compared with vertebrates, the invertebrate genomes underwent a drastic expansion in the number of the nACh-like genes associated with receptors of unknown function. Understanding this diversity contributes to better insight into the evolution and possible functional divergence of these receptors. In this work, we studied orphan receptor Alpo4 from an extreme thermophile worm . Sequence analysis points towards its remote relation to characterized nACh receptors. We solved the cryo-EM structure of the lophotrochozoan nACh-like receptor in which a CHAPS molecule is tightly bound to the orthosteric site. We show that the binding of CHAPS leads to extending of the loop C at the orthosteric site and a quaternary twist between extracellular and transmembrane domains. Both the ligand binding site and the channel pore reveal unique features. These include a conserved Trp residue in loop B of the ligand binding site which is flipped into an apparent self-liganded state in the apo structure. The ion pore of Alpo4 is tightly constricted by a ring of methionines near the extracellular entryway of the channel pore. Our data provide a structural basis for a functional understanding of Alpo4 and hints towards new strategies for designing specific channel modulators. |
 リンク リンク |  Elife / Elife /  PubMed:37395731 / PubMed:37395731 /  PubMed Central PubMed Central |
| 手法 | EM (単粒子) |
| 解像度 | 3.4 - 6.2 Å |
| 構造データ | EMDB-16308, PDB-8bx5: EMDB-16314, PDB-8bxb: EMDB-16315, PDB-8bxd: EMDB-16316, PDB-8bxe: EMDB-16317, PDB-8bxf: EMDB-16326, PDB-8byi: |
| 化合物 |  ChemComp-NAG:  ChemComp-HOH: 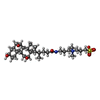 ChemComp-CPS:  ChemComp-NA: |
| 由来 |
|
 キーワード キーワード | MEMBRANE PROTEIN / Cys-loop receptor / pentameric ligand-gated ion channel / Alpo / nAChR |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について



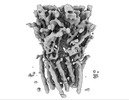

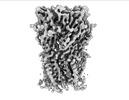

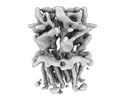

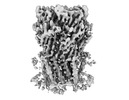

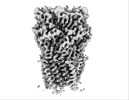

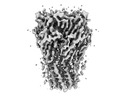

 alvinella pompejana (無脊椎動物)
alvinella pompejana (無脊椎動物)