+検索条件
-Structure paper
| タイトル | Active site conformational changes of prostasin provide a new mechanism of protease regulation by divalent cations. |
|---|---|
| ジャーナル・号・ページ | Protein Sci., Vol. 18, Page 1081-1094, Year 2009 |
| 掲載日 | 2008年7月31日 (構造データの登録日) |
 著者 著者 | Spraggon, G. / Hornsby, M. / Shipway, A. / Tully, D.C. / Bursulaya, B. / Danahay, H. / Harris, J.L. / Lesley, S.A. |
 リンク リンク |  Protein Sci. / Protein Sci. /  PubMed:19388054 PubMed:19388054 |
| 手法 | X線回折 |
| 解像度 | 1.3 - 2.8 Å |
| 構造データ |  PDB-3e0n:  PDB-3e1x:  PDB-3fvf:  PDB-3gyl:  PDB-3gym: |
| 化合物 |  ChemComp-SO4:  ChemComp-GOL:  ChemComp-HOH: 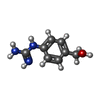 ChemComp-1JZ:  ChemComp-DMS:  ChemComp-CA: |
| 由来 |
|
 キーワード キーワード | HYDROLASE / PROSTASIN / PROTEASE / chloromethyl-ketone / Channel / ENaC / Cell membrane / Glycoprotein / Membrane / Secreted / Serine protease / Transmembrane / Zymogen / HCAP-1 / Channel Activating Protease / INHIBITOR / DIVALENT CATION / CHANNEL ACTIVATING / Disulfide bond / HYDROLASE/INHIBITOR / hCAP1 / Aprotinin / inhibition / Pharmaceutical / Protease inhibitor / Serine protease inhibitor / HYDROLASE-INHIBITOR COMPLEX |
 ムービー
ムービー コントローラー
コントローラー 構造ビューア
構造ビューア 万見文献について
万見文献について



 homo sapiens (ヒト)
homo sapiens (ヒト)
