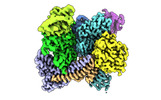
登録情報 データベース : EMDB / ID : EMD-25707タイトル Cryo-EM Structure of a Transition State of Arp2/3 Complex Activation Main map post processed with deepEMhancer 複合体 : bovine Arp2/3 complex and Actin, CapZ複合体 : bovine Arp2/3複合体 : Actin skeletal muscle複合体 : F-actin-capping proteinリガンド : x 3種 / / / / / / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Bos taurus (ウシ) / Oryctolagus cuniculus (ウサギ) / Homo sapiens (ヒト) / cattle (ウシ) / rabbit (ウサギ) / Mus musculus (ハツカネズミ)手法 / / 解像度 : 3.4 Å Rebowski G / van Eeuwen T / Boczkowska M / Dominguez R 資金援助 Organization Grant number 国 National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) R01-GM07391 National Institutes of Health/National Institute of General Medical Sciences (NIH/NIGMS) T32-GM008275 National Institutes of Health/National Heart, Lung, and Blood Institute (NIH/NHLBI) F31-HL146077
ジャーナル : To Be Published タイトル : Cryo-EM structure of an Arp2/3 complex mini-branch capped by capping protein (CapZ)著者 : Rebowski G / van Eeuwen T / Dominguez R / Boczkowska M 履歴 登録 2021年12月13日 - ヘッダ(付随情報) 公開 2023年6月14日 - マップ公開 2023年6月14日 - 更新 2023年8月2日 - 現状 2023年8月2日 処理サイト : RCSB / 状態 : 公開
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報
 マップデータ
マップデータ 試料
試料 キーワード
キーワード 機能・相同性情報
機能・相同性情報

 Homo sapiens (ヒト) /
Homo sapiens (ヒト) / 


 データ登録者
データ登録者 米国, 3件
米国, 3件  引用
引用 ジャーナル: To Be Published
ジャーナル: To Be Published 構造の表示
構造の表示 ダウンロードとリンク
ダウンロードとリンク emd_25707.map.gz
emd_25707.map.gz EMDBマップデータ形式
EMDBマップデータ形式 emd-25707-v30.xml
emd-25707-v30.xml emd-25707.xml
emd-25707.xml EMDBヘッダ
EMDBヘッダ emd_25707_fsc.xml
emd_25707_fsc.xml FSCデータファイル
FSCデータファイル emd_25707.png
emd_25707.png emd_25707_additional_1.map.gz
emd_25707_additional_1.map.gz emd_25707_additional_2.map.gz
emd_25707_additional_2.map.gz emd_25707_half_map_1.map.gz
emd_25707_half_map_1.map.gz emd_25707_half_map_2.map.gz
emd_25707_half_map_2.map.gz http://ftp.pdbj.org/pub/emdb/structures/EMD-25707
http://ftp.pdbj.org/pub/emdb/structures/EMD-25707 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25707
ftp://ftp.pdbj.org/pub/emdb/structures/EMD-25707
 F&H 検索
F&H 検索 リンク
リンク EMDB (EBI/PDBe) /
EMDB (EBI/PDBe) /  EMDataResource
EMDataResource マップ
マップ ダウンロード / ファイル: emd_25707.map.gz / 形式: CCP4 / 大きさ: 166.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES)
ダウンロード / ファイル: emd_25707.map.gz / 形式: CCP4 / 大きさ: 166.4 MB / タイプ: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) 試料の構成要素
試料の構成要素 解析
解析 試料調製
試料調製 電子顕微鏡法
電子顕微鏡法 FIELD EMISSION GUN
FIELD EMISSION GUN
 ムービー
ムービー コントローラー
コントローラー





























 Z
Z Y
Y X
X