+ Open data
Open data
- Basic information
Basic information
| Entry | Database: EMDB / ID: EMD-2219 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Title | Cryo-EM structure of gastric H+,K+-ATPase with bound Rb+ | |||||||||
 Map data Map data | Reconstruction of H+,K+-ATPase with Rb+ | |||||||||
 Sample Sample |
| |||||||||
 Keywords Keywords | P-type ATPase / Gastric H+/K+-ATPase / proton pump | |||||||||
| Function / homology |  Function and homology information Function and homology informationH+/K+-exchanging ATPase / potassium:proton exchanging ATPase complex / P-type potassium:proton transporter activity / Ion transport by P-type ATPases / P-type sodium:potassium-exchanging transporter activity / sodium:potassium-exchanging ATPase complex / ATP biosynthetic process / sodium ion export across plasma membrane / intracellular potassium ion homeostasis / intracellular sodium ion homeostasis ...H+/K+-exchanging ATPase / potassium:proton exchanging ATPase complex / P-type potassium:proton transporter activity / Ion transport by P-type ATPases / P-type sodium:potassium-exchanging transporter activity / sodium:potassium-exchanging ATPase complex / ATP biosynthetic process / sodium ion export across plasma membrane / intracellular potassium ion homeostasis / intracellular sodium ion homeostasis / potassium ion import across plasma membrane / potassium ion binding / ATPase activator activity / potassium ion transmembrane transport / proton transmembrane transport / cell adhesion / apical plasma membrane / magnesium ion binding / ATP hydrolysis activity / ATP binding / plasma membrane Similarity search - Function | |||||||||
| Biological species |  | |||||||||
| Method | electron crystallography / cryo EM / Resolution: 8.0 Å | |||||||||
 Authors Authors | Abe K / Tani K / Friedrich T / Fujiyoshi Y | |||||||||
 Citation Citation |  Journal: Proc Natl Acad Sci U S A / Year: 2012 Journal: Proc Natl Acad Sci U S A / Year: 2012Title: Cryo-EM structure of gastric H+,K+-ATPase with a single occupied cation-binding site. Authors: Kazuhiro Abe / Kazutoshi Tani / Thomas Friedrich / Yoshinori Fujiyoshi /  Abstract: Gastric H(+),K(+)-ATPase is responsible for gastric acid secretion. ATP-driven H(+) uptake into the stomach is efficiently accomplished by the exchange of an equal amount of K(+), resulting in a ...Gastric H(+),K(+)-ATPase is responsible for gastric acid secretion. ATP-driven H(+) uptake into the stomach is efficiently accomplished by the exchange of an equal amount of K(+), resulting in a luminal pH close to 1. Because of the limited free energy available for ATP hydrolysis, the stoichiometry of transported cations is thought to vary from 2H(+)/2K(+) to 1H(+)/1K(+) per hydrolysis of one ATP molecule as the luminal pH decreases, although direct evidence for this hypothesis has remained elusive. Here, we show, using the phosphate analog aluminum fluoride (AlF) and a K(+) congener (Rb(+)), the 8-Å resolution structure of H(+),K(+)-ATPase in the transition state of dephosphorylation, (Rb(+))E2~AlF, which is distinct from the preceding Rb(+)-free E2P state. A strong density located in the transmembrane cation-binding site of (Rb(+))E2~AlF highly likely represents a single bound Rb(+) ion, which is clearly different from the Rb(+)-free E2AlF or K(+)-bound (K(+))E2~AlF structures. Measurement of radioactive (86)Rb(+) binding suggests that the binding stoichiometry varies depending on the pH, and approximately half of the amount of Rb(+) is bound under acidic crystallization conditions compared with at a neutral pH. These data represent structural and biochemical evidence for the 1H(+)/1K(+)/1ATP transport mode of H(+),K(+)-ATPase, which is a prerequisite for generation of the 10(6)-fold proton gradient in terms of thermodynamics. Together with the released E2P-stabilizing interaction between the β subunit's N terminus and the P domain observed in the (Rb(+))E2~AlF structure, we propose a refined vectorial transport model of H(+),K(+)-ATPase, which must prevail against the highly acidic state of the gastric lumen. | |||||||||
| History |
|
- Structure visualization
Structure visualization
| Movie |
 Movie viewer Movie viewer |
|---|---|
| Structure viewer | EM map:  SurfView SurfView Molmil Molmil Jmol/JSmol Jmol/JSmol |
| Supplemental images |
- Downloads & links
Downloads & links
-EMDB archive
| Map data |  emd_2219.map.gz emd_2219.map.gz | 2 MB |  EMDB map data format EMDB map data format | |
|---|---|---|---|---|
| Header (meta data) |  emd-2219-v30.xml emd-2219-v30.xml emd-2219.xml emd-2219.xml | 10.3 KB 10.3 KB | Display Display |  EMDB header EMDB header |
| Images |  EMD-2219.jpg EMD-2219.jpg | 43.4 KB | ||
| Archive directory |  http://ftp.pdbj.org/pub/emdb/structures/EMD-2219 http://ftp.pdbj.org/pub/emdb/structures/EMD-2219 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2219 ftp://ftp.pdbj.org/pub/emdb/structures/EMD-2219 | HTTPS FTP |
-Validation report
| Summary document |  emd_2219_validation.pdf.gz emd_2219_validation.pdf.gz | 220 KB | Display |  EMDB validaton report EMDB validaton report |
|---|---|---|---|---|
| Full document |  emd_2219_full_validation.pdf.gz emd_2219_full_validation.pdf.gz | 219.1 KB | Display | |
| Data in XML |  emd_2219_validation.xml.gz emd_2219_validation.xml.gz | 4.5 KB | Display | |
| Arichive directory |  https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2219 https://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2219 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2219 ftp://ftp.pdbj.org/pub/emdb/validation_reports/EMD-2219 | HTTPS FTP |
-Related structure data
| Related structure data |  2yn9MC  2220C M: atomic model generated by this map C: citing same article ( |
|---|---|
| Similar structure data | Similarity search - Function & homology  F&H Search F&H Search |
- Links
Links
| EMDB pages |  EMDB (EBI/PDBe) / EMDB (EBI/PDBe) /  EMDataResource EMDataResource |
|---|---|
| Related items in Molecule of the Month |
- Map
Map
| File |  Download / File: emd_2219.map.gz / Format: CCP4 / Size: 2.7 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) Download / File: emd_2219.map.gz / Format: CCP4 / Size: 2.7 MB / Type: IMAGE STORED AS FLOATING POINT NUMBER (4 BYTES) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Annotation | Reconstruction of H+,K+-ATPase with Rb+ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Projections & slices | Image control
Images are generated by Spider. generated in cubic-lattice coordinate | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Voxel size | X: 1.8433 Å / Y: 1.9583 Å / Z: 2 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
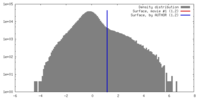
| Density |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Symmetry | Space group: 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Details | EMDB XML:
CCP4 map header:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
-Supplemental data
- Sample components
Sample components
-Entire : H+,K+-ATPase bound with Rb+
| Entire | Name: H+,K+-ATPase bound with Rb+ |
|---|---|
| Components |
|
-Supramolecule #1000: H+,K+-ATPase bound with Rb+
| Supramolecule | Name: H+,K+-ATPase bound with Rb+ / type: sample / ID: 1000 / Oligomeric state: One alpha and one beta chain of HK-ATPase / Number unique components: 1 |
|---|---|
| Molecular weight | Theoretical: 150 KDa |
-Macromolecule #1: POTASSIUM-TRANSPORTING ATPASE
| Macromolecule | Name: POTASSIUM-TRANSPORTING ATPASE / type: protein_or_peptide / ID: 1 / Number of copies: 2 / Oligomeric state: Dimer / Recombinant expression: No / Database: NCBI |
|---|---|
| Source (natural) | Organism:  |
| Molecular weight | Theoretical: 150 KDa |
| Sequence | GO: ATP biosynthetic process / InterPro: P-type ATPase, A domain superfamily |
-Experimental details
-Structure determination
| Method | cryo EM |
|---|---|
 Processing Processing | electron crystallography |
| Aggregation state | 2D array |
- Sample preparation
Sample preparation
| Concentration | 8 mg/mL |
|---|---|
| Buffer | pH: 4.8 Details: 20mM propionate, 1mM ADP, 3mM DTT,pH 4.8-4.9 adjusted by Tris, 1mM MgCl2, 1mM AlCl3, 4mM NaF, 10mM RbCl |
| Grid | Details: molybdenum grid with thin carbon support |
| Vitrification | Cryogen name: NITROGEN / Instrument: LEICA KF80 Details: Vitrification carried out in cold room at 4 degrees Celsius |
| Details | Crystals grown in dialysis |
| Crystal formation | Details: Crystals grown in dialysis |
- Electron microscopy
Electron microscopy
| Microscope | JEOL KYOTO-3000SFF |
|---|---|
| Date | Mar 23, 2010 |
| Image recording | Category: FILM / Film or detector model: KODAK SO-163 FILM / Digitization - Scanner: ZEISS SCAI / Digitization - Sampling interval: 7 µm / Number real images: 248 / Bits/pixel: 12 |
| Electron beam | Acceleration voltage: 300 kV / Electron source:  FIELD EMISSION GUN FIELD EMISSION GUN |
| Electron optics | Calibrated magnification: 39500 / Illumination mode: FLOOD BEAM / Imaging mode: BRIGHT FIELD / Cs: 1.6 mm / Nominal defocus max: 3.48 µm / Nominal defocus min: 0.83 µm / Nominal magnification: 40000 |
| Sample stage | Specimen holder: Helium cooled / Specimen holder model: JEOL / Tilt angle min: -60 / Tilt angle max: 60 / Tilt series - Axis1 - Min angle: -60 ° / Tilt series - Axis1 - Max angle: 60 ° |
- Image processing
Image processing
| Details | Images were processed using MRC suite. |
|---|---|
| Final reconstruction | Resolution.type: BY AUTHOR / Resolution: 8.0 Å / Software - Name: MRC |
| Crystal parameters | Unit cell - A: 141.0 Å / Unit cell - B: 110.6 Å / Unit cell - C: 320.0 Å / Unit cell - γ: 90.0 ° / Unit cell - α: 90.0 ° / Unit cell - β: 90.0 ° / Plane group: P 2 21 21 |
| CTF correction | Details: Each image |
 Movie
Movie Controller
Controller







 Z (Sec.)
Z (Sec.) X (Row.)
X (Row.) Y (Col.)
Y (Col.)