+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 9asb | ||||||
|---|---|---|---|---|---|---|---|
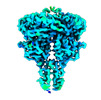
| タイトル | Structure of human calcium-sensing receptor in complex with chimeric Gq (miniGisq) protein in nanodiscs | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  MEMBRANE PROTEIN (膜タンパク質) / MEMBRANE PROTEIN (膜タンパク質) /  Calcium-sensing receptor (カルシウム感知受容体) / Calcium-sensing receptor (カルシウム感知受容体) /  G-protein-coupled receptor (Gタンパク質共役受容体) / G-protein-coupled receptor (Gタンパク質共役受容体) /  G protein (Gタンパク質) / G protein (Gタンパク質) /  signal transduction (シグナル伝達) signal transduction (シグナル伝達) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報bile acid secretion / chemosensory behavior / cellular response to peptide / response to fibroblast growth factor / cellular response to vitamin D / phosphatidylinositol phospholipase C activity / Class C/3 (Metabotropic glutamate/pheromone receptors) / calcium ion import / positive regulation of positive chemotaxis / fat pad development ...bile acid secretion / chemosensory behavior / cellular response to peptide / response to fibroblast growth factor / cellular response to vitamin D / phosphatidylinositol phospholipase C activity / Class C/3 (Metabotropic glutamate/pheromone receptors) / calcium ion import / positive regulation of positive chemotaxis / fat pad development /  amino acid binding / cellular response to hepatocyte growth factor stimulus / branching morphogenesis of an epithelial tube / positive regulation of calcium ion import / regulation of calcium ion transport / cellular response to low-density lipoprotein particle stimulus / detection of calcium ion / Adenylate cyclase inhibitory pathway / positive regulation of protein localization to cell cortex / anatomical structure morphogenesis / regulation of cAMP-mediated signaling / D2 dopamine receptor binding / G protein-coupled serotonin receptor binding / axon terminus / regulation of mitotic spindle organization / cellular response to forskolin / JNK cascade / positive regulation of vasoconstriction / chloride transmembrane transport / adenylate cyclase-inhibiting G protein-coupled receptor signaling pathway / amino acid binding / cellular response to hepatocyte growth factor stimulus / branching morphogenesis of an epithelial tube / positive regulation of calcium ion import / regulation of calcium ion transport / cellular response to low-density lipoprotein particle stimulus / detection of calcium ion / Adenylate cyclase inhibitory pathway / positive regulation of protein localization to cell cortex / anatomical structure morphogenesis / regulation of cAMP-mediated signaling / D2 dopamine receptor binding / G protein-coupled serotonin receptor binding / axon terminus / regulation of mitotic spindle organization / cellular response to forskolin / JNK cascade / positive regulation of vasoconstriction / chloride transmembrane transport / adenylate cyclase-inhibiting G protein-coupled receptor signaling pathway /  骨化 / Regulation of insulin secretion / G protein-coupled receptor binding / response to ischemia / G protein-coupled receptor activity / cellular response to glucose stimulus / Olfactory Signaling Pathway / G-protein beta/gamma-subunit complex binding / Activation of the phototransduction cascade / G beta:gamma signalling through PLC beta / Presynaptic function of Kainate receptors / Thromboxane signalling through TP receptor / adenylate cyclase-modulating G protein-coupled receptor signaling pathway / G-protein activation / G protein-coupled acetylcholine receptor signaling pathway / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / Prostacyclin signalling through prostacyclin receptor / Glucagon signaling in metabolic regulation / G beta:gamma signalling through CDC42 / positive regulation of insulin secretion / ADP signalling through P2Y purinoceptor 12 / G beta:gamma signalling through BTK / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / Sensory perception of sweet, bitter, and umami (glutamate) taste / photoreceptor disc membrane / response to peptide hormone / Adrenaline,noradrenaline inhibits insulin secretion / Glucagon-type ligand receptors / Vasopressin regulates renal water homeostasis via Aquaporins / intracellular calcium ion homeostasis / G alpha (z) signalling events / cellular response to catecholamine stimulus / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / ADORA2B mediated anti-inflammatory cytokines production / adenylate cyclase-activating dopamine receptor signaling pathway / ADP signalling through P2Y purinoceptor 1 / G beta:gamma signalling through PI3Kgamma / cellular response to prostaglandin E stimulus / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding / 骨化 / Regulation of insulin secretion / G protein-coupled receptor binding / response to ischemia / G protein-coupled receptor activity / cellular response to glucose stimulus / Olfactory Signaling Pathway / G-protein beta/gamma-subunit complex binding / Activation of the phototransduction cascade / G beta:gamma signalling through PLC beta / Presynaptic function of Kainate receptors / Thromboxane signalling through TP receptor / adenylate cyclase-modulating G protein-coupled receptor signaling pathway / G-protein activation / G protein-coupled acetylcholine receptor signaling pathway / Activation of G protein gated Potassium channels / Inhibition of voltage gated Ca2+ channels via Gbeta/gamma subunits / Prostacyclin signalling through prostacyclin receptor / Glucagon signaling in metabolic regulation / G beta:gamma signalling through CDC42 / positive regulation of insulin secretion / ADP signalling through P2Y purinoceptor 12 / G beta:gamma signalling through BTK / Synthesis, secretion, and inactivation of Glucagon-like Peptide-1 (GLP-1) / Sensory perception of sweet, bitter, and umami (glutamate) taste / photoreceptor disc membrane / response to peptide hormone / Adrenaline,noradrenaline inhibits insulin secretion / Glucagon-type ligand receptors / Vasopressin regulates renal water homeostasis via Aquaporins / intracellular calcium ion homeostasis / G alpha (z) signalling events / cellular response to catecholamine stimulus / Glucagon-like Peptide-1 (GLP1) regulates insulin secretion / ADORA2B mediated anti-inflammatory cytokines production / adenylate cyclase-activating dopamine receptor signaling pathway / ADP signalling through P2Y purinoceptor 1 / G beta:gamma signalling through PI3Kgamma / cellular response to prostaglandin E stimulus / Cooperation of PDCL (PhLP1) and TRiC/CCT in G-protein beta folding /  vasodilation / sensory perception of taste / GPER1 signaling / G-protein beta-subunit binding / GDP binding / Inactivation, recovery and regulation of the phototransduction cascade / vasodilation / sensory perception of taste / GPER1 signaling / G-protein beta-subunit binding / GDP binding / Inactivation, recovery and regulation of the phototransduction cascade /  heterotrimeric G-protein complex / G alpha (12/13) signalling events / heterotrimeric G-protein complex / G alpha (12/13) signalling events /  extracellular vesicle / signaling receptor complex adaptor activity / Thrombin signalling through proteinase activated receptors (PARs) / extracellular vesicle / signaling receptor complex adaptor activity / Thrombin signalling through proteinase activated receptors (PARs) /  integrin binding / retina development in camera-type eye / integrin binding / retina development in camera-type eye /  GTPase binding / Ca2+ pathway / phospholipase C-activating G protein-coupled receptor signaling pathway / GTPase binding / Ca2+ pathway / phospholipase C-activating G protein-coupled receptor signaling pathway /  細胞皮質 / midbody / G alpha (i) signalling events / fibroblast proliferation / cellular response to hypoxia / G alpha (s) signalling events / G alpha (q) signalling events / basolateral plasma membrane / Ras protein signal transduction / cell population proliferation / transmembrane transporter binding / Extra-nuclear estrogen signaling / positive regulation of ERK1 and ERK2 cascade / 細胞皮質 / midbody / G alpha (i) signalling events / fibroblast proliferation / cellular response to hypoxia / G alpha (s) signalling events / G alpha (q) signalling events / basolateral plasma membrane / Ras protein signal transduction / cell population proliferation / transmembrane transporter binding / Extra-nuclear estrogen signaling / positive regulation of ERK1 and ERK2 cascade /  細胞周期 細胞周期類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  単粒子再構成法 / 単粒子再構成法 /  クライオ電子顕微鏡法 / 解像度: 3.4 Å クライオ電子顕微鏡法 / 解像度: 3.4 Å | ||||||
 データ登録者 データ登録者 | Zuo, H. / Park, J. / Frangaj, A. / Ye, J. / Lu, G. / Manning, J.J. / Asher, W.B. / Lu, Z. / Hu, G. / Wang, L. ...Zuo, H. / Park, J. / Frangaj, A. / Ye, J. / Lu, G. / Manning, J.J. / Asher, W.B. / Lu, Z. / Hu, G. / Wang, L. / Mendez, J. / Eng, E. / Zhang, Z. / Lin, X. / Grasucci, R. / Hendrickson, W.A. / Clarke, O.B. / Javitch, J.A. / Conigrave, A.D. / Fan, Q.R. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Nature / 年: 2024 ジャーナル: Nature / 年: 2024タイトル: Promiscuous G-protein activation by the calcium-sensing receptor. 著者: Hao Zuo / Jinseo Park / Aurel Frangaj / Jianxiang Ye / Guanqi Lu / Jamie J Manning / Wesley B Asher / Zhengyuan Lu / Guo-Bin Hu / Liguo Wang / Joshua Mendez / Edward Eng / Zhening Zhang / Xin ...著者: Hao Zuo / Jinseo Park / Aurel Frangaj / Jianxiang Ye / Guanqi Lu / Jamie J Manning / Wesley B Asher / Zhengyuan Lu / Guo-Bin Hu / Liguo Wang / Joshua Mendez / Edward Eng / Zhening Zhang / Xin Lin / Robert Grassucci / Wayne A Hendrickson / Oliver B Clarke / Jonathan A Javitch / Arthur D Conigrave / Qing R Fan /   要旨: The human calcium-sensing receptor (CaSR) detects fluctuations in the extracellular Ca concentration and maintains Ca homeostasis. It also mediates diverse cellular processes not associated with Ca ...The human calcium-sensing receptor (CaSR) detects fluctuations in the extracellular Ca concentration and maintains Ca homeostasis. It also mediates diverse cellular processes not associated with Ca balance. The functional pleiotropy of CaSR arises in part from its ability to signal through several G-protein subtypes. We determined structures of CaSR in complex with G proteins from three different subfamilies: G, G and G. We found that the homodimeric CaSR of each complex couples to a single G protein through a common mode. This involves the C-terminal helix of each Gα subunit binding to a shallow pocket that is formed in one CaSR subunit by all three intracellular loops (ICL1-ICL3), an extended transmembrane helix 3 and an ordered C-terminal region. G-protein binding expands the transmembrane dimer interface, which is further stabilized by phospholipid. The restraint imposed by the receptor dimer, in combination with ICL2, enables G-protein activation by facilitating conformational transition of Gα. We identified a single Gα residue that determines G and G versus G selectivity. The length and flexibility of ICL2 allows CaSR to bind all three Gα subtypes, thereby conferring capacity for promiscuous G-protein coupling. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  9asb.cif.gz 9asb.cif.gz | 424.2 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb9asb.ent.gz pdb9asb.ent.gz | 表示 |  PDB形式 PDB形式 | |
| PDBx/mmJSON形式 |  9asb.json.gz 9asb.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/as/9asb https://data.pdbj.org/pub/pdb/validation_reports/as/9asb ftp://data.pdbj.org/pub/pdb/validation_reports/as/9asb ftp://data.pdbj.org/pub/pdb/validation_reports/as/9asb | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  43811MC  9avgC  9avlC  9axfC  9ayfC M: このデータのモデリングに利用したマップデータ C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | 類似検索 - 機能・相同性  F&H 検索 F&H 検索 |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 |
|
- 要素
要素
-タンパク質 , 2種, 3分子 QRB
| #1: タンパク質 | 分子量: 102864.617 Da / 分子数: 2 / 由来タイプ: 組換発現 詳細: The CaSR construct consists of residues 1-903 and a Flag tag inserted after the signal peptide 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: CASR, GPRC2A, PCAR1 / 細胞株 (発現宿主): HEK293 GnTI- / 発現宿主: Homo sapiens (ヒト) / 遺伝子: CASR, GPRC2A, PCAR1 / 細胞株 (発現宿主): HEK293 GnTI- / 発現宿主:   Homo sapiens (ヒト) / 参照: UniProt: P41180 Homo sapiens (ヒト) / 参照: UniProt: P41180#3: タンパク質 | | 分子量: 38413.895 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: The guanine nucleotide-binding protein G(I)/G(S)/G(T) subunit beta-1 construct contains a Flag epitope fused to the N-terminus. 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: GNB1 / 細胞株 (発現宿主): HEK293 GnTI- / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GNB1 / 細胞株 (発現宿主): HEK293 GnTI- / 発現宿主:   Homo sapiens (ヒト) / 参照: UniProt: P62873 Homo sapiens (ヒト) / 参照: UniProt: P62873 |
|---|
-Chimeric mini guanine nucleotide-binding protein G(i)(s)(q) subunit ... , 2種, 2分子 AG
| #2: タンパク質 | 分子量: 28306.148 Da / 分子数: 1 / 由来タイプ: 組換発現 詳細: MiniG(q) alpha is a chimeric protein engineered based on the miniG(s) alpha skeleton [miniG(s)(q) alpha]. Chimeric miniG(i)(s)(q) alpha construct was designed where the N-terminal 25 amino ...詳細: MiniG(q) alpha is a chimeric protein engineered based on the miniG(s) alpha skeleton [miniG(s)(q) alpha]. Chimeric miniG(i)(s)(q) alpha construct was designed where the N-terminal 25 amino acids of G(s) alpha was replaced with the initial 18 residues of G(i1) alpha 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: GNAI1, GNAS / 細胞株 (発現宿主): HEK293 GnTl- / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GNAI1, GNAS / 細胞株 (発現宿主): HEK293 GnTl- / 発現宿主:   Homo sapiens (ヒト) / 参照: UniProt: P63096, UniProt: A0A590UJY2 Homo sapiens (ヒト) / 参照: UniProt: P63096, UniProt: A0A590UJY2 |
|---|---|
| #4: タンパク質 | 分子量: 7861.143 Da / 分子数: 1 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: GNG2 / 細胞株 (発現宿主): HEK293 GnTI- / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GNG2 / 細胞株 (発現宿主): HEK293 GnTI- / 発現宿主:   Homo sapiens (ヒト) / 参照: UniProt: P59768 Homo sapiens (ヒト) / 参照: UniProt: P59768 |
-糖 , 2種, 10分子 
| #5: 多糖 | 2-acetamido-2-deoxy-beta-D-glucopyranose-(1-4)-2-acetamido-2-deoxy-beta-D-glucopyranose  オリゴ糖 / 分子量: 424.401 Da / 分子数: 4 / 由来タイプ: 組換発現 オリゴ糖 / 分子量: 424.401 Da / 分子数: 4 / 由来タイプ: 組換発現#6: 糖 | ChemComp-NAG /  N-アセチルグルコサミン N-アセチルグルコサミン |
|---|
-非ポリマー , 6種, 14分子 








| #7: 化合物 | | #8: 化合物 |  リン酸塩 リン酸塩#9: 化合物 | ChemComp-CA / #10: 化合物 | #11: 化合物 | ChemComp-Y01 / | #12: 化合物 | ChemComp-A1AF7 / ( | 分子量: 749.007 Da / 分子数: 1 / 由来タイプ: 合成 / 式: C40H77O10P |
|---|
-詳細
| 研究の焦点であるリガンドがあるか | N |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: PARTICLE / 3次元再構成法:  単粒子再構成法 単粒子再構成法 |
- 試料調製
試料調製
| 構成要素 | 名称: Human CaSR in complex with chimeric Gq (miniGisq) protein タイプ: COMPLEX / Entity ID: #1-#4 / 由来: RECOMBINANT | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 分子量 | 値: 0.276 MDa / 実験値: NO | |||||||||||||||||||||||||||||||||||
| 由来(天然) | 生物種:   Homo sapiens (ヒト) Homo sapiens (ヒト) | |||||||||||||||||||||||||||||||||||
| 由来(組換発現) | 生物種:   Homo sapiens (ヒト) / 細胞: HEK293 GnTI- Homo sapiens (ヒト) / 細胞: HEK293 GnTI- | |||||||||||||||||||||||||||||||||||
| 緩衝液 | pH: 7.5 | |||||||||||||||||||||||||||||||||||
| 緩衝液成分 |
| |||||||||||||||||||||||||||||||||||
| 試料 | 濃度: 3.6 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES | |||||||||||||||||||||||||||||||||||
| 試料支持 | グリッドの材料: GOLD / グリッドのサイズ: 300 divisions/in. / グリッドのタイプ: Quantifoil R0.6/1 | |||||||||||||||||||||||||||||||||||
急速凍結 | 装置: FEI VITROBOT MARK IV / 凍結剤: ETHANE / 湿度: 100 % / 凍結前の試料温度: 277 K / 詳細: The sample was blotted for 6s before plunge-frozen. |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 300 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 1900 nm / 最小 デフォーカス(公称値): 1200 nm / Cs Bright-field microscopy / 倍率(公称値): 105000 X / 最大 デフォーカス(公称値): 1900 nm / 最小 デフォーカス(公称値): 1200 nm / Cs : 2.7 mm / C2レンズ絞り径: 100 µm / アライメント法: COMA FREE : 2.7 mm / C2レンズ絞り径: 100 µm / アライメント法: COMA FREE |
| 試料ホルダ | 凍結剤: NITROGEN 試料ホルダーモデル: FEI TITAN KRIOS AUTOGRID HOLDER 最高温度: 100 K |
| 撮影 | 平均露光時間: 3 sec. / 電子線照射量: 74.9 e/Å2 フィルム・検出器のモデル: GATAN K3 BIOQUANTUM (6k x 4k) 撮影したグリッド数: 1 / 実像数: 9336 |
| 電子光学装置 | エネルギーフィルター名称 : GIF Bioquantum / エネルギーフィルタースリット幅: 15 eV : GIF Bioquantum / エネルギーフィルタースリット幅: 15 eV |
| 画像スキャン | 横: 11520 / 縦: 8184 |
- 解析
解析
| EMソフトウェア |
| ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | タイプ: PHASE FLIPPING AND AMPLITUDE CORRECTION | ||||||||||||||||||||||||||||||||||||
| 粒子像の選択 | 選択した粒子像数: 1339334 | ||||||||||||||||||||||||||||||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | ||||||||||||||||||||||||||||||||||||
3次元再構成 | 解像度: 3.4 Å / 解像度の算出法: FSC 0.143 CUT-OFF / 粒子像の数: 91042 / 対称性のタイプ: POINT | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | プロトコル: FLEXIBLE FIT / 空間: REAL | ||||||||||||||||||||||||||||||||||||
| 原子モデル構築 | 3D fitting-ID: 1 / Source name: PDB / タイプ: experimental model
| ||||||||||||||||||||||||||||||||||||
| 拘束条件 |
|
 ムービー
ムービー コントローラー
コントローラー


























 PDBj
PDBj


































