+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 4bzi | ||||||
|---|---|---|---|---|---|---|---|
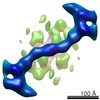
| タイトル | The structure of the COPII coat assembled on membranes | ||||||
 要素 要素 |
| ||||||
 キーワード キーワード |  TRANSPORT PROTEIN (運搬体タンパク質) / TRANSPORT PROTEIN (運搬体タンパク質) /  SECRETION (分泌) / TRAFFICKING / SEC23 / SEC24 / SECRETION (分泌) / TRAFFICKING / SEC23 / SEC24 /  SAR1 (COPII) SAR1 (COPII) | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報Antigen Presentation: Folding, assembly and peptide loading of class I MHC / Cargo concentration in the ER / regulation of COPII vesicle coating / positive regulation of ER to Golgi vesicle-mediated transport / mitochondria-associated endoplasmic reticulum membrane contact site / COPII-mediated vesicle transport / nuclear envelope organization / COPII-coated vesicle cargo loading / vesicle organization / COPII vesicle coat ...Antigen Presentation: Folding, assembly and peptide loading of class I MHC / Cargo concentration in the ER / regulation of COPII vesicle coating / positive regulation of ER to Golgi vesicle-mediated transport / mitochondria-associated endoplasmic reticulum membrane contact site / COPII-mediated vesicle transport / nuclear envelope organization / COPII-coated vesicle cargo loading / vesicle organization / COPII vesicle coat / positive regulation of protein exit from endoplasmic reticulum / membrane organization /  signal sequence binding / signal sequence binding /  mitochondrial fission / mitochondrial membrane organization / fungal-type vacuole membrane / reticulophagy / endoplasmic reticulum to Golgi vesicle-mediated transport / endoplasmic reticulum exit site / vesicle-mediated transport / mitochondrial fission / mitochondrial membrane organization / fungal-type vacuole membrane / reticulophagy / endoplasmic reticulum to Golgi vesicle-mediated transport / endoplasmic reticulum exit site / vesicle-mediated transport /  GTPase activator activity / GTPase activator activity /  SNARE binding / SNARE binding /  オートファジー / オートファジー /  加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 / 加水分解酵素; 酸無水物に作用; GTPに作用・細胞または細胞小器官の運動に関与 /  intracellular protein transport / ER to Golgi transport vesicle membrane / intracellular protein transport / ER to Golgi transport vesicle membrane /  ゴルジ体 / ゴルジ体 /  GTPase activity / GTP binding / endoplasmic reticulum membrane / GTPase activity / GTP binding / endoplasmic reticulum membrane /  ゴルジ体 / ゴルジ体 /  小胞体 / 小胞体 /  ミトコンドリア / zinc ion binding ミトコンドリア / zinc ion binding類似検索 - 分子機能 | ||||||
| 生物種 |   SACCHAROMYCES CEREVISIAE (パン酵母) SACCHAROMYCES CEREVISIAE (パン酵母) | ||||||
| 手法 |  電子顕微鏡法 / 電子顕微鏡法 /  電子線トモグラフィー法 / 電子線トモグラフィー法 /  クライオ電子顕微鏡法 / 解像度: 23 Å クライオ電子顕微鏡法 / 解像度: 23 Å | ||||||
 データ登録者 データ登録者 | Zanetti, G. / Prinz, S. / Daum, S. / Meister, A. / Schekman, R. / Bacia, K. / Briggs, J.A.G. | ||||||
 引用 引用 |  ジャーナル: Elife / 年: 2013 ジャーナル: Elife / 年: 2013タイトル: The structure of the COPII transport-vesicle coat assembled on membranes. 著者: Giulia Zanetti / Simone Prinz / Sebastian Daum / Annette Meister / Randy Schekman / Kirsten Bacia / John A G Briggs /  要旨: Coat protein complex II (COPII) mediates formation of the membrane vesicles that export newly synthesised proteins from the endoplasmic reticulum. The inner COPII proteins bind to cargo and membrane, ...Coat protein complex II (COPII) mediates formation of the membrane vesicles that export newly synthesised proteins from the endoplasmic reticulum. The inner COPII proteins bind to cargo and membrane, linking them to the outer COPII components that form a cage around the vesicle. Regulated flexibility in coat architecture is essential for transport of a variety of differently sized cargoes, but structural data on the assembled coat has not been available. We have used cryo-electron tomography and subtomogram averaging to determine the structure of the complete, membrane-assembled COPII coat. We describe a novel arrangement of the outer coat and find that the inner coat can assemble into regular lattices. The data reveal how coat subunits interact with one another and with the membrane, suggesting how coordinated assembly of inner and outer coats can mediate and regulate packaging of vesicles ranging from small spheres to large tubular carriers. DOI:http://dx.doi.org/10.7554/eLife.00951.001. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| ムービー |
 ムービービューア ムービービューア |
|---|---|
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  4bzi.cif.gz 4bzi.cif.gz | 1011.3 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb4bzi.ent.gz pdb4bzi.ent.gz | 806.9 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  4bzi.json.gz 4bzi.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/bz/4bzi https://data.pdbj.org/pub/pdb/validation_reports/bz/4bzi ftp://data.pdbj.org/pub/pdb/validation_reports/bz/4bzi ftp://data.pdbj.org/pub/pdb/validation_reports/bz/4bzi | HTTPS FTP |
|---|
-関連構造データ
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
|
|---|---|
| 1 | 
|
- 要素
要素
-タンパク質 , 4種, 12分子 ADGBJKELMFNO
| #1: タンパク質 | 分子量: 85463.242 Da / 分子数: 3 / 由来タイプ: 組換発現 由来: (組換発現)   SACCHAROMYCES CEREVISIAE (パン酵母) SACCHAROMYCES CEREVISIAE (パン酵母)プラスミド: PTKY9 / 発現宿主:   SACCHAROMYCES CEREVISIAE (パン酵母) / 株 (発現宿主): RSY3764 / 参照: UniProt: E7QAP0, UniProt: P15303*PLUS SACCHAROMYCES CEREVISIAE (パン酵母) / 株 (発現宿主): RSY3764 / 参照: UniProt: E7QAP0, UniProt: P15303*PLUS#2: タンパク質 | 分子量: 21472.564 Da / 分子数: 3 / 由来タイプ: 組換発現 由来: (組換発現)   SACCHAROMYCES CEREVISIAE (パン酵母) SACCHAROMYCES CEREVISIAE (パン酵母)プラスミド: PTY40 / 発現宿主:   ESCHERICHIA COLI (大腸菌) / 株 (発現宿主): BL21 / Variant (発現宿主): KBB1012 / 参照: UniProt: C8ZIG2, UniProt: P20606*PLUS ESCHERICHIA COLI (大腸菌) / 株 (発現宿主): BL21 / Variant (発現宿主): KBB1012 / 参照: UniProt: C8ZIG2, UniProt: P20606*PLUS#3: タンパク質 | 分子量: 103733.250 Da / 分子数: 3 / 由来タイプ: 組換発現 由来: (組換発現)   SACCHAROMYCES CEREVISIAE (パン酵母) SACCHAROMYCES CEREVISIAE (パン酵母)プラスミド: PTKY9 / 発現宿主:   SACCHAROMYCES CEREVISIAE (パン酵母) / 株 (発現宿主): RSY3764 / 参照: UniProt: C8ZAD6, UniProt: P40482*PLUS SACCHAROMYCES CEREVISIAE (パン酵母) / 株 (発現宿主): RSY3764 / 参照: UniProt: C8ZAD6, UniProt: P40482*PLUS#4: タンパク質 | 分子量: 103675.172 Da / 分子数: 3 / 由来タイプ: 組換発現 由来: (組換発現)   SACCHAROMYCES CEREVISIAE (パン酵母) SACCHAROMYCES CEREVISIAE (パン酵母)プラスミド: PTKY9 / 発現宿主:   SACCHAROMYCES CEREVISIAE (パン酵母) / 株 (発現宿主): RSY3764 / 参照: UniProt: C8ZAD6, UniProt: P40482*PLUS SACCHAROMYCES CEREVISIAE (パン酵母) / 株 (発現宿主): RSY3764 / 参照: UniProt: C8ZAD6, UniProt: P40482*PLUS |
|---|
-非ポリマー , 3種, 12分子 




| #5: 化合物 | ChemComp-ZN / #6: 化合物 |  5'-Guanylyl imidodiphosphate 5'-Guanylyl imidodiphosphate#7: 化合物 | |
|---|
-実験情報
-実験
| 実験 | 手法:  電子顕微鏡法 電子顕微鏡法 |
|---|---|
| EM実験 | 試料の集合状態: HELICAL ARRAY / 3次元再構成法:  電子線トモグラフィー法 電子線トモグラフィー法 |
- 試料調製
試料調製
| 構成要素 | 名称: SEC23-23-SAR1 / タイプ: COMPLEX |
|---|---|
| 緩衝液 | 名称: MM HEPES, 50 MM KOAC, 1.2 MM MGCL2 / pH: 6.8 / 詳細: MM HEPES, 50 MM KOAC, 1.2 MM MGCL2 |
| 試料 | 濃度: 0.03 mg/ml / 包埋: NO / シャドウイング: NO / 染色 : NO / 凍結 : NO / 凍結 : YES : YES |
| 試料支持 | 詳細: HOLEY CARBON |
急速凍結 | 装置: HOMEMADE PLUNGER / 凍結剤: ETHANE / 詳細: LIQUID ETHANE |
- 電子顕微鏡撮影
電子顕微鏡撮影
| 実験機器 |  モデル: Titan Krios / 画像提供: FEI Company |
|---|---|
| 顕微鏡 | モデル: FEI TITAN KRIOS / 日付: 2012年9月18日 |
| 電子銃 | 電子線源 : :  FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM FIELD EMISSION GUN / 加速電圧: 200 kV / 照射モード: FLOOD BEAM |
| 電子レンズ | モード: BRIGHT FIELD Bright-field microscopy / 倍率(公称値): 19500 X / 最大 デフォーカス(公称値): 3200 nm / 最小 デフォーカス(公称値): 2000 nm / Cs Bright-field microscopy / 倍率(公称値): 19500 X / 最大 デフォーカス(公称値): 3200 nm / 最小 デフォーカス(公称値): 2000 nm / Cs : 2.7 mm : 2.7 mm |
| 試料ホルダ | 傾斜角・最大: 60 ° / 傾斜角・最小: -60 ° |
| 撮影 | 電子線照射量: 80 e/Å2 / フィルム・検出器のモデル: GATAN MULTISCAN |
| 画像スキャン | デジタル画像の数: 26 |
- 解析
解析
| EMソフトウェア |
| |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
CTF補正 | 詳細: EACH TILTED IMAGE WITHIN TOMOGRAM | |||||||||||||||
| 対称性 | 点対称性 : C1 (非対称) : C1 (非対称) | |||||||||||||||
3次元再構成 | 手法: SUBTOMOGRAM ALIGNMENT AND AVERAGING / 解像度: 23 Å / 粒子像の数: 15000 / ピクセルサイズ(実測値): 4.3 Å 詳細: SUBMISSION BASED ON EXPERIMENTAL DATA FROM EMDB EMD-2428. (DEPOSITION ID: 11856). 対称性のタイプ: POINT | |||||||||||||||
| 原子モデル構築 | プロトコル: RIGID BODY FIT / 空間: REAL / Target criteria: Cross-correlation coefficient / 詳細: METHOD--RIGID BODY REFINEMENT PROTOCOL--X-RAY | |||||||||||||||
| 原子モデル構築 | PDB-ID: 1M2O | |||||||||||||||
| 精密化 | 最高解像度: 23 Å | |||||||||||||||
| 精密化ステップ | サイクル: LAST / 最高解像度: 23 Å
|
 ムービー
ムービー コントローラー
コントローラー














 PDBj
PDBj











