+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 6qw3 | ||||||
|---|---|---|---|---|---|---|---|
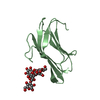
| タイトル | Calcium-bound gelsolin domain 2 | ||||||
 要素 要素 | Gelsolin | ||||||
 キーワード キーワード |  STRUCTURAL PROTEIN (タンパク質) / STRUCTURAL PROTEIN (タンパク質) /  amyloidosis (アミロイドーシス) / amyloidosis (アミロイドーシス) /  gelsolin / actin-binding gelsolin / actin-binding | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報striated muscle atrophy / regulation of establishment of T cell polarity / regulation of plasma membrane raft polarization / regulation of receptor clustering /  renal protein absorption / positive regulation of keratinocyte apoptotic process / positive regulation of protein processing in phagocytic vesicle / positive regulation of actin nucleation / phosphatidylinositol 3-kinase catalytic subunit binding / positive regulation of cysteine-type endopeptidase activity involved in apoptotic signaling pathway ...striated muscle atrophy / regulation of establishment of T cell polarity / regulation of plasma membrane raft polarization / regulation of receptor clustering / renal protein absorption / positive regulation of keratinocyte apoptotic process / positive regulation of protein processing in phagocytic vesicle / positive regulation of actin nucleation / phosphatidylinositol 3-kinase catalytic subunit binding / positive regulation of cysteine-type endopeptidase activity involved in apoptotic signaling pathway ...striated muscle atrophy / regulation of establishment of T cell polarity / regulation of plasma membrane raft polarization / regulation of receptor clustering /  renal protein absorption / positive regulation of keratinocyte apoptotic process / positive regulation of protein processing in phagocytic vesicle / positive regulation of actin nucleation / phosphatidylinositol 3-kinase catalytic subunit binding / positive regulation of cysteine-type endopeptidase activity involved in apoptotic signaling pathway / actin cap / renal protein absorption / positive regulation of keratinocyte apoptotic process / positive regulation of protein processing in phagocytic vesicle / positive regulation of actin nucleation / phosphatidylinositol 3-kinase catalytic subunit binding / positive regulation of cysteine-type endopeptidase activity involved in apoptotic signaling pathway / actin cap /  regulation of podosome assembly / sequestering of actin monomers / regulation of podosome assembly / sequestering of actin monomers /  myosin II binding / negative regulation of viral entry into host cell / actin filament severing / actin filament capping / barbed-end actin filament capping / actin polymerization or depolymerization / actin filament depolymerization / cell projection assembly / cardiac muscle cell contraction / myosin II binding / negative regulation of viral entry into host cell / actin filament severing / actin filament capping / barbed-end actin filament capping / actin polymerization or depolymerization / actin filament depolymerization / cell projection assembly / cardiac muscle cell contraction /  podosome / Sensory processing of sound by outer hair cells of the cochlea / relaxation of cardiac muscle / podosome / Sensory processing of sound by outer hair cells of the cochlea / relaxation of cardiac muscle /  phagocytosis, engulfment / cortical actin cytoskeleton / hepatocyte apoptotic process / phagocytosis, engulfment / cortical actin cytoskeleton / hepatocyte apoptotic process /  cilium assembly / cilium assembly /  筋形質 / Caspase-mediated cleavage of cytoskeletal proteins / phagocytic vesicle / 筋形質 / Caspase-mediated cleavage of cytoskeletal proteins / phagocytic vesicle /  phosphatidylinositol-4,5-bisphosphate binding / response to muscle stretch / actin filament polymerization / phosphatidylinositol-4,5-bisphosphate binding / response to muscle stretch / actin filament polymerization /  central nervous system development / actin filament organization / protein destabilization / cellular response to type II interferon / central nervous system development / actin filament organization / protein destabilization / cellular response to type II interferon /  actin filament binding / actin filament binding /  マイクロフィラメント / マイクロフィラメント /  lamellipodium / lamellipodium /  actin binding / secretory granule lumen / ficolin-1-rich granule lumen / amyloid fibril formation / blood microparticle / Amyloid fiber formation / actin binding / secretory granule lumen / ficolin-1-rich granule lumen / amyloid fibril formation / blood microparticle / Amyloid fiber formation /  focal adhesion / focal adhesion /  calcium ion binding / Neutrophil degranulation / positive regulation of gene expression / calcium ion binding / Neutrophil degranulation / positive regulation of gene expression /  extracellular space / extracellular exosome / extracellular region / extracellular space / extracellular exosome / extracellular region /  細胞膜 / 細胞膜 /  細胞質基質 / 細胞質基質 /  細胞質 細胞質類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 1.3 Å 分子置換 / 解像度: 1.3 Å | ||||||
 データ登録者 データ登録者 | Scalone, E. / Boni, F. / Milani, M. / Mastrangelo, E. / de Rosa, M. | ||||||
| 資金援助 |  米国, 1件 米国, 1件
| ||||||
 引用 引用 |  ジャーナル: Biochem.Biophys.Res.Commun. / 年: 2019 ジャーナル: Biochem.Biophys.Res.Commun. / 年: 2019タイトル: High-resolution crystal structure of gelsolin domain 2 in complex with the physiological calcium ion. 著者: Bollati, M. / Scalone, E. / Boni, F. / Mastrangelo, E. / Giorgino, T. / Milani, M. / de Rosa, M. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  6qw3.cif.gz 6qw3.cif.gz | 66.1 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb6qw3.ent.gz pdb6qw3.ent.gz | 47.8 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  6qw3.json.gz 6qw3.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/qw/6qw3 https://data.pdbj.org/pub/pdb/validation_reports/qw/6qw3 ftp://data.pdbj.org/pub/pdb/validation_reports/qw/6qw3 ftp://data.pdbj.org/pub/pdb/validation_reports/qw/6qw3 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ |  1kcqS S: 精密化の開始モデル |
|---|---|
| 類似構造データ |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 |
| ||||||||||||
| 単位格子 |
| ||||||||||||
| Components on special symmetry positions |
|
- 要素
要素
| #1: タンパク質 |  / AGEL / Actin-depolymerizing factor / ADF / Brevin / AGEL / Actin-depolymerizing factor / ADF / Brevin分子量: 13166.648 Da / 分子数: 1 / 由来タイプ: 組換発現 / 詳細: gelsolin domain 2 (G2) / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: GSN / 発現宿主: Homo sapiens (ヒト) / 遺伝子: GSN / 発現宿主:   Escherichia coli (大腸菌) / 参照: UniProt: P06396 Escherichia coli (大腸菌) / 参照: UniProt: P06396 |
|---|---|
| #2: 化合物 | ChemComp-CA / |
| #3: 水 | ChemComp-HOH /  水 水 |
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 1.8 Å3/Da / 溶媒含有率: 31.74 % |
|---|---|
結晶化 | 温度: 298 K / 手法: 蒸気拡散法, シッティングドロップ法 / pH: 5.5 / 詳細: 36% PEG5000 MME, 0.1M Sodium Acetate |
-データ収集
| 回折 | 平均測定温度: 100 K / Serial crystal experiment: N |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  Diamond Diamond  / ビームライン: I04 / 波長: 0.9795 Å / ビームライン: I04 / 波長: 0.9795 Å |
| 検出器 | タイプ: DECTRIS EIGER X 16M / 検出器: PIXEL / 日付: 2019年2月10日 |
| 放射 | プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 0.9795 Å / 相対比: 1 : 0.9795 Å / 相対比: 1 |
| 反射 | 解像度: 1.3→70.82 Å / Num. obs: 24096 / % possible obs: 99.5 % / 冗長度: 10.8 % / CC1/2: 0.999 / Rmerge(I) obs: 0.077 / Rpim(I) all: 0.023 / Rrim(I) all: 0.08 / Net I/σ(I): 14 |
| 反射 シェル | 解像度: 1.3→1.32 Å / 冗長度: 4.3 % / Rmerge(I) obs: 0.764 / Mean I/σ(I) obs: 1.8 / Num. unique obs: 1103 / CC1/2: 0.579 / Rpim(I) all: 0.409 / Rrim(I) all: 0.874 / % possible all: 92.9 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  分子置換 分子置換開始モデル: 1KCQ 解像度: 1.3→40.995 Å / SU ML: 0.11 / 交差検証法: FREE R-VALUE / σ(F): 1.34 / 位相誤差: 17.75
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | 減衰半径: 0.9 Å / VDWプローブ半径: 1.11 Å | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 1.3→40.995 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー












 PDBj
PDBj




