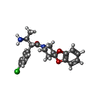
| 登録情報 | データベース: PDB / ID: 6fk8
|
|---|
| タイトル | Crystal structure of N2C/D282C stabilized opsin bound to RS08 |
|---|
 要素 要素 | Rhodopsin ロドプシン ロドプシン |
|---|
 キーワード キーワード |  MEMBRANE PROTEIN (膜タンパク質) / MEMBRANE PROTEIN (膜タンパク質) /  RHODOPSIN (ロドプシン) / RHODOPSIN (ロドプシン) /  G PROTEIN-COUPLED RECEPTORS (Gタンパク質共役受容体) / G PROTEIN-COUPLED RECEPTORS (Gタンパク質共役受容体) /  RETINITIS PIGMENTOSA (網膜色素変性症) / RETINITIS PIGMENTOSA (網膜色素変性症) /  SIGNALING PROTEIN / SIGNALING PROTEIN /  SENSORY TRANSDUCTION / SENSORY TRANSDUCTION /  PHOTORECEPTOR PROTEIN / KINTEGRAL MEMBRANE PROTEIN / VISION / PHOTORECEPTOR PROTEIN / KINTEGRAL MEMBRANE PROTEIN / VISION /  MEMBRANE (生体膜) / MEMBRANE (生体膜) /  RECEPTOR (受容体) / TRANSDUCER PHOTORECEPTOR / RECEPTOR (受容体) / TRANSDUCER PHOTORECEPTOR /  SMALL MOLECULE COMPLEX (小分子) SMALL MOLECULE COMPLEX (小分子) |
|---|
| 機能・相同性 |  機能・相同性情報 機能・相同性情報 |
|---|
| 生物種 |    Bos taurus (ウシ) Bos taurus (ウシ) |
|---|
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  分子置換 / 解像度: 2.87 Å 分子置換 / 解像度: 2.87 Å |
|---|
 データ登録者 データ登録者 | Mattle, D. / Standfuss, J. / Dawson, R. |
|---|
| 資金援助 |  スイス, 1件 スイス, 1件 | 組織 | 認可番号 | 国 |
|---|
| Roche | RPF |  スイス スイス |
|
|---|
 引用 引用 |  ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 2018 ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 2018
タイトル: Ligand channel in pharmacologically stabilized rhodopsin.
著者: Mattle, D. / Kuhn, B. / Aebi, J. / Bedoucha, M. / Kekilli, D. / Grozinger, N. / Alker, A. / Rudolph, M.G. / Schmid, G. / Schertler, G.F.X. / Hennig, M. / Standfuss, J. / Dawson, R.J.P. |
|---|
| 履歴 | | 登録 | 2018年1月23日 | 登録サイト: PDBE / 処理サイト: PDBE |
|---|
| 改定 1.0 | 2018年4月4日 | Provider: repository / タイプ: Initial release |
|---|
| 改定 1.1 | 2018年4月11日 | Group: Data collection / Database references / カテゴリ: citation
Item: _citation.journal_volume / _citation.page_first / _citation.page_last |
|---|
| 改定 2.0 | 2020年7月29日 | Group: Atomic model / Data collection ...Atomic model / Data collection / Derived calculations / Refinement description / Structure summary
カテゴリ: atom_site / atom_site_anisotrop ...atom_site / atom_site_anisotrop / chem_comp / entity / pdbx_branch_scheme / pdbx_chem_comp_identifier / pdbx_entity_branch / pdbx_entity_branch_descriptor / pdbx_entity_branch_link / pdbx_entity_branch_list / pdbx_entity_nonpoly / pdbx_nonpoly_scheme / pdbx_struct_assembly_gen / refine_hist / struct_asym / struct_conn / struct_site / struct_site_gen
Item: _atom_site.B_iso_or_equiv / _atom_site.Cartn_x ..._atom_site.B_iso_or_equiv / _atom_site.Cartn_x / _atom_site.Cartn_y / _atom_site.Cartn_z / _atom_site.auth_asym_id / _atom_site.auth_atom_id / _atom_site.auth_comp_id / _atom_site.auth_seq_id / _atom_site.label_asym_id / _atom_site.label_atom_id / _atom_site.label_comp_id / _atom_site.label_entity_id / _atom_site.type_symbol / _atom_site_anisotrop.U[1][1] / _atom_site_anisotrop.U[1][2] / _atom_site_anisotrop.U[1][3] / _atom_site_anisotrop.U[2][2] / _atom_site_anisotrop.U[2][3] / _atom_site_anisotrop.U[3][3] / _atom_site_anisotrop.pdbx_auth_asym_id / _atom_site_anisotrop.pdbx_auth_atom_id / _atom_site_anisotrop.pdbx_auth_comp_id / _atom_site_anisotrop.pdbx_auth_seq_id / _atom_site_anisotrop.pdbx_label_asym_id / _atom_site_anisotrop.pdbx_label_atom_id / _atom_site_anisotrop.pdbx_label_comp_id / _atom_site_anisotrop.type_symbol / _chem_comp.mon_nstd_flag / _chem_comp.name / _chem_comp.type / _pdbx_struct_assembly_gen.asym_id_list / _refine_hist.d_res_low / _struct_conn.pdbx_role / _struct_conn.ptnr1_auth_asym_id / _struct_conn.ptnr1_auth_seq_id / _struct_conn.ptnr1_label_asym_id / _struct_conn.ptnr2_auth_asym_id / _struct_conn.ptnr2_auth_seq_id / _struct_conn.ptnr2_label_asym_id
解説: Carbohydrate remediation / Provider: repository / タイプ: Remediation |
|---|
| 改定 2.1 | 2024年1月17日 | Group: Data collection / Database references ...Data collection / Database references / Derived calculations / Refinement description / Structure summary
カテゴリ: chem_comp / chem_comp_atom ...chem_comp / chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model / struct_conn
Item: _chem_comp.pdbx_synonyms / _database_2.pdbx_DOI ..._chem_comp.pdbx_synonyms / _database_2.pdbx_DOI / _database_2.pdbx_database_accession / _struct_conn.pdbx_leaving_atom_flag |
|---|
|
|---|
 データを開く
データを開く 基本情報
基本情報 要素
要素 ロドプシン
ロドプシン  キーワード
キーワード MEMBRANE PROTEIN (膜タンパク質) /
MEMBRANE PROTEIN (膜タンパク質) /  RHODOPSIN (ロドプシン) /
RHODOPSIN (ロドプシン) /  G PROTEIN-COUPLED RECEPTORS (Gタンパク質共役受容体) /
G PROTEIN-COUPLED RECEPTORS (Gタンパク質共役受容体) /  RETINITIS PIGMENTOSA (網膜色素変性症) /
RETINITIS PIGMENTOSA (網膜色素変性症) /  SIGNALING PROTEIN /
SIGNALING PROTEIN /  SENSORY TRANSDUCTION /
SENSORY TRANSDUCTION /  PHOTORECEPTOR PROTEIN / KINTEGRAL MEMBRANE PROTEIN / VISION /
PHOTORECEPTOR PROTEIN / KINTEGRAL MEMBRANE PROTEIN / VISION /  MEMBRANE (生体膜) /
MEMBRANE (生体膜) /  RECEPTOR (受容体) / TRANSDUCER PHOTORECEPTOR /
RECEPTOR (受容体) / TRANSDUCER PHOTORECEPTOR /  SMALL MOLECULE COMPLEX (小分子)
SMALL MOLECULE COMPLEX (小分子) 機能・相同性情報
機能・相同性情報 Opsins / VxPx cargo-targeting to cilium / rod bipolar cell differentiation / rod photoreceptor outer segment / sperm head plasma membrane / absorption of visible light /
Opsins / VxPx cargo-targeting to cilium / rod bipolar cell differentiation / rod photoreceptor outer segment / sperm head plasma membrane / absorption of visible light /  podosome assembly /
podosome assembly /  opsin binding / The canonical retinoid cycle in rods (twilight vision) / : ...
opsin binding / The canonical retinoid cycle in rods (twilight vision) / : ... Opsins / VxPx cargo-targeting to cilium / rod bipolar cell differentiation / rod photoreceptor outer segment / sperm head plasma membrane / absorption of visible light /
Opsins / VxPx cargo-targeting to cilium / rod bipolar cell differentiation / rod photoreceptor outer segment / sperm head plasma membrane / absorption of visible light /  podosome assembly /
podosome assembly /  opsin binding / The canonical retinoid cycle in rods (twilight vision) / : / G protein-coupled photoreceptor activity / photoreceptor inner segment membrane / G protein-coupled opsin signaling pathway /
opsin binding / The canonical retinoid cycle in rods (twilight vision) / : / G protein-coupled photoreceptor activity / photoreceptor inner segment membrane / G protein-coupled opsin signaling pathway /  11-cis retinal binding / cellular response to light stimulus / G protein-coupled receptor complex / Inactivation, recovery and regulation of the phototransduction cascade /
11-cis retinal binding / cellular response to light stimulus / G protein-coupled receptor complex / Inactivation, recovery and regulation of the phototransduction cascade /  phototransduction, visible light /
phototransduction, visible light /  thermotaxis / Activation of the phototransduction cascade / outer membrane / detection of temperature stimulus involved in thermoception / arrestin family protein binding /
thermotaxis / Activation of the phototransduction cascade / outer membrane / detection of temperature stimulus involved in thermoception / arrestin family protein binding /  photoreceptor cell maintenance / photoreceptor outer segment membrane / G alpha (i) signalling events /
photoreceptor cell maintenance / photoreceptor outer segment membrane / G alpha (i) signalling events /  phototransduction / response to light stimulus / photoreceptor outer segment / G-protein alpha-subunit binding / sperm midpiece /
phototransduction / response to light stimulus / photoreceptor outer segment / G-protein alpha-subunit binding / sperm midpiece /  視覚 / guanyl-nucleotide exchange factor activity / photoreceptor disc membrane / microtubule cytoskeleton organization / cell-cell junction /
視覚 / guanyl-nucleotide exchange factor activity / photoreceptor disc membrane / microtubule cytoskeleton organization / cell-cell junction /  遺伝子発現 / G protein-coupled receptor signaling pathway /
遺伝子発現 / G protein-coupled receptor signaling pathway /  ゴルジ体 / zinc ion binding /
ゴルジ体 / zinc ion binding /  生体膜 / identical protein binding /
生体膜 / identical protein binding /  細胞膜
細胞膜
 Bos taurus (ウシ)
Bos taurus (ウシ) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.87 Å
分子置換 / 解像度: 2.87 Å  データ登録者
データ登録者 スイス, 1件
スイス, 1件  引用
引用 ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 2018
ジャーナル: Proc. Natl. Acad. Sci. U.S.A. / 年: 2018 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 6fk8.cif.gz
6fk8.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb6fk8.ent.gz
pdb6fk8.ent.gz PDB形式
PDB形式 6fk8.json.gz
6fk8.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/fk/6fk8
https://data.pdbj.org/pub/pdb/validation_reports/fk/6fk8 ftp://data.pdbj.org/pub/pdb/validation_reports/fk/6fk8
ftp://data.pdbj.org/pub/pdb/validation_reports/fk/6fk8 リンク
リンク 集合体
集合体
 要素
要素 ロドプシン
ロドプシン
 Bos taurus (ウシ) / 遺伝子: RHO / プラスミド: PCMV-TET O / 細胞株 (発現宿主): HEK293S GNTI- / 発現宿主:
Bos taurus (ウシ) / 遺伝子: RHO / プラスミド: PCMV-TET O / 細胞株 (発現宿主): HEK293S GNTI- / 発現宿主: 
 Homo sapiens (ヒト) / 参照: UniProt: P02699
Homo sapiens (ヒト) / 参照: UniProt: P02699 オリゴ糖 / 分子量: 910.823 Da / 分子数: 1 / 由来タイプ: 組換発現
オリゴ糖 / 分子量: 910.823 Da / 分子数: 1 / 由来タイプ: 組換発現 パルミチン酸
パルミチン酸 Octyl glucoside
Octyl glucoside X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  SLS
SLS  / ビームライン: X10SA / 波長: 1 Å
/ ビームライン: X10SA / 波長: 1 Å : 1 Å / 相対比: 1
: 1 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー





















 PDBj
PDBj