登録情報 データベース : PDB / ID : 3p87タイトル Structure of human PCNA bound to RNASEH2B PIP box peptide Proliferating cell nuclear antigen Ribonuclease H2 subunit B キーワード / / / / / / / / / / / / / / / / 機能・相同性 分子機能 ドメイン・相同性 構成要素
/ / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / / 生物種 Homo sapiens (ヒト)手法 / / / 解像度 : 2.99 Å データ登録者 Bubeck, D. / Reijns, M.A. / Graham, S.C. / Astell, K.R. / Jones, E.Y. / Jackson, A.P. ジャーナル : Nucleic Acids Res. / 年 : 2011タイトル : PCNA directs type 2 RNase H activity on DNA replication and repair substrates.著者 : Bubeck, D. / Reijns, M.A. / Graham, S.C. / Astell, K.R. / Jones, E.Y. / Jackson, A.P. 履歴 登録 2010年10月13日 登録サイト / 処理サイト 改定 1.0 2011年2月2日 Provider / タイプ 改定 1.1 2011年7月13日 Group 改定 1.2 2014年4月2日 Group 改定 1.3 2023年9月6日 Group / Database references / Refinement descriptionカテゴリ chem_comp_atom / chem_comp_bond ... chem_comp_atom / chem_comp_bond / database_2 / pdbx_initial_refinement_model Item / _database_2.pdbx_database_accession
すべて表示 表示を減らす
 データを開く
データを開く 基本情報
基本情報 要素
要素 キーワード
キーワード DNA binding (デオキシリボ核酸) /
DNA binding (デオキシリボ核酸) /  DNA replication (DNA複製) /
DNA replication (DNA複製) /  DNA repair (DNA修復) /
DNA repair (DNA修復) /  sliding clamp (DNAクランプ) / PCNA Peptide Interacting Peptide (PIP) motif / PIP-box motif /
sliding clamp (DNAクランプ) / PCNA Peptide Interacting Peptide (PIP) motif / PIP-box motif /  DNA clamp (DNAクランプ) / processivity factor / RNase H2 / FEN-1 /
DNA clamp (DNAクランプ) / processivity factor / RNase H2 / FEN-1 /  Ligase (リガーゼ) / polymerases / helicases / nucleases /
Ligase (リガーゼ) / polymerases / helicases / nucleases /  nucleus (細胞核) / HYDROLASE-DNA BINDING PROTEIN complex
nucleus (細胞核) / HYDROLASE-DNA BINDING PROTEIN complex 機能・相同性情報
機能・相同性情報 核ラミナ / MutLalpha complex binding ...ribonucleotide metabolic process / ribonuclease H2 complex / positive regulation of deoxyribonuclease activity / dinucleotide insertion or deletion binding / PCNA-p21 complex / mitotic telomere maintenance via semi-conservative replication / purine-specific mismatch base pair DNA N-glycosylase activity / positive regulation of DNA-directed DNA polymerase activity /
核ラミナ / MutLalpha complex binding ...ribonucleotide metabolic process / ribonuclease H2 complex / positive regulation of deoxyribonuclease activity / dinucleotide insertion or deletion binding / PCNA-p21 complex / mitotic telomere maintenance via semi-conservative replication / purine-specific mismatch base pair DNA N-glycosylase activity / positive regulation of DNA-directed DNA polymerase activity /  核ラミナ / MutLalpha complex binding / Polymerase switching / Telomere C-strand (Lagging Strand) Synthesis / Processive synthesis on the lagging strand /
核ラミナ / MutLalpha complex binding / Polymerase switching / Telomere C-strand (Lagging Strand) Synthesis / Processive synthesis on the lagging strand /  PCNA complex /
PCNA complex /  regulation of DNA damage checkpoint / Removal of the Flap Intermediate / Processive synthesis on the C-strand of the telomere / Mismatch repair (MMR) directed by MSH2:MSH3 (MutSbeta) / Polymerase switching on the C-strand of the telomere / Mismatch repair (MMR) directed by MSH2:MSH6 (MutSalpha) / Transcription of E2F targets under negative control by DREAM complex / Removal of the Flap Intermediate from the C-strand /
regulation of DNA damage checkpoint / Removal of the Flap Intermediate / Processive synthesis on the C-strand of the telomere / Mismatch repair (MMR) directed by MSH2:MSH3 (MutSbeta) / Polymerase switching on the C-strand of the telomere / Mismatch repair (MMR) directed by MSH2:MSH6 (MutSalpha) / Transcription of E2F targets under negative control by DREAM complex / Removal of the Flap Intermediate from the C-strand /  replisome / RNA catabolic process / response to L-glutamate /
replisome / RNA catabolic process / response to L-glutamate /  histone acetyltransferase binding / DNA polymerase processivity factor activity / G1/S-Specific Transcription / leading strand elongation / replication fork processing / response to dexamethasone / nuclear replication fork / SUMOylation of DNA replication proteins /
histone acetyltransferase binding / DNA polymerase processivity factor activity / G1/S-Specific Transcription / leading strand elongation / replication fork processing / response to dexamethasone / nuclear replication fork / SUMOylation of DNA replication proteins /  estrous cycle / PCNA-Dependent Long Patch Base Excision Repair / cyclin-dependent protein kinase holoenzyme complex /
estrous cycle / PCNA-Dependent Long Patch Base Excision Repair / cyclin-dependent protein kinase holoenzyme complex /  DNAミスマッチ修復 /
DNAミスマッチ修復 /  DNA修復 / response to cadmium ion /
DNA修復 / response to cadmium ion /  DNA polymerase binding / epithelial cell differentiation / regulation of G2/M transition of mitotic cell cycle / positive regulation of DNA repair / Translesion synthesis by REV1 /
DNA polymerase binding / epithelial cell differentiation / regulation of G2/M transition of mitotic cell cycle / positive regulation of DNA repair / Translesion synthesis by REV1 /  base-excision repair, gap-filling / Translesion synthesis by POLK / Translesion synthesis by POLI / Gap-filling DNA repair synthesis and ligation in GG-NER / TP53 Regulates Transcription of Genes Involved in G2 Cell Cycle Arrest /
base-excision repair, gap-filling / Translesion synthesis by POLK / Translesion synthesis by POLI / Gap-filling DNA repair synthesis and ligation in GG-NER / TP53 Regulates Transcription of Genes Involved in G2 Cell Cycle Arrest /  DNA複製 / positive regulation of DNA replication / male germ cell nucleus /
DNA複製 / positive regulation of DNA replication / male germ cell nucleus /  liver regeneration / nuclear estrogen receptor binding / Recognition of DNA damage by PCNA-containing replication complex / Termination of translesion DNA synthesis / Translesion Synthesis by POLH / HDR through Homologous Recombination (HRR) / Dual Incision in GG-NER /
liver regeneration / nuclear estrogen receptor binding / Recognition of DNA damage by PCNA-containing replication complex / Termination of translesion DNA synthesis / Translesion Synthesis by POLH / HDR through Homologous Recombination (HRR) / Dual Incision in GG-NER /  receptor tyrosine kinase binding / cellular response to hydrogen peroxide / Dual incision in TC-NER / Gap-filling DNA repair synthesis and ligation in TC-NER / cellular response to UV / positive regulation of fibroblast proliferation / cellular response to xenobiotic stimulus / E3 ubiquitin ligases ubiquitinate target proteins / response to estradiol /
receptor tyrosine kinase binding / cellular response to hydrogen peroxide / Dual incision in TC-NER / Gap-filling DNA repair synthesis and ligation in TC-NER / cellular response to UV / positive regulation of fibroblast proliferation / cellular response to xenobiotic stimulus / E3 ubiquitin ligases ubiquitinate target proteins / response to estradiol /  heart development /
heart development /  遺伝子発現 / fibroblast proliferation / in utero embryonic development / damaged DNA binding /
遺伝子発現 / fibroblast proliferation / in utero embryonic development / damaged DNA binding /  chromosome, telomeric region /
chromosome, telomeric region /  nuclear body / negative regulation of gene expression /
nuclear body / negative regulation of gene expression /  中心体 /
中心体 /  chromatin binding /
chromatin binding /  クロマチン / protein-containing complex binding /
クロマチン / protein-containing complex binding /  enzyme binding / negative regulation of transcription by RNA polymerase II / extracellular exosome /
enzyme binding / negative regulation of transcription by RNA polymerase II / extracellular exosome /  核質 / identical protein binding /
核質 / identical protein binding /  細胞核
細胞核
 Homo sapiens (ヒト)
Homo sapiens (ヒト) X線回折 /
X線回折 /  シンクロトロン /
シンクロトロン /  分子置換 / 解像度: 2.99 Å
分子置換 / 解像度: 2.99 Å  データ登録者
データ登録者 引用
引用 ジャーナル: Nucleic Acids Res. / 年: 2011
ジャーナル: Nucleic Acids Res. / 年: 2011 構造の表示
構造の表示 Molmil
Molmil Jmol/JSmol
Jmol/JSmol ダウンロードとリンク
ダウンロードとリンク ダウンロード
ダウンロード 3p87.cif.gz
3p87.cif.gz PDBx/mmCIF形式
PDBx/mmCIF形式 pdb3p87.ent.gz
pdb3p87.ent.gz PDB形式
PDB形式 3p87.json.gz
3p87.json.gz PDBx/mmJSON形式
PDBx/mmJSON形式 その他のダウンロード
その他のダウンロード https://data.pdbj.org/pub/pdb/validation_reports/p8/3p87
https://data.pdbj.org/pub/pdb/validation_reports/p8/3p87 ftp://data.pdbj.org/pub/pdb/validation_reports/p8/3p87
ftp://data.pdbj.org/pub/pdb/validation_reports/p8/3p87 リンク
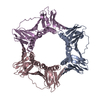
リンク 集合体
集合体
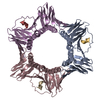

 要素
要素 増殖細胞核抗原 / PCNA / Cyclin
増殖細胞核抗原 / PCNA / Cyclin
 Homo sapiens (ヒト) / 遺伝子: PCNA / プラスミド: pT7.7 / 発現宿主:
Homo sapiens (ヒト) / 遺伝子: PCNA / プラスミド: pT7.7 / 発現宿主: 
 Escherichia coli (大腸菌) / 株 (発現宿主): BL21 / 参照: UniProt: P12004
Escherichia coli (大腸菌) / 株 (発現宿主): BL21 / 参照: UniProt: P12004
 Homo sapiens (ヒト) / 参照: UniProt: Q5TBB1
Homo sapiens (ヒト) / 参照: UniProt: Q5TBB1 X線回折 / 使用した結晶の数: 1
X線回折 / 使用した結晶の数: 1  試料調製
試料調製
 シンクロトロン / サイト:
シンクロトロン / サイト:  Diamond
Diamond  / ビームライン: I03 / 波長: 0.982 Å
/ ビームライン: I03 / 波長: 0.982 Å : 0.982 Å / 相対比: 1
: 0.982 Å / 相対比: 1  解析
解析 :
:  分子置換
分子置換 ムービー
ムービー コントローラー
コントローラー










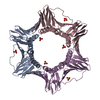



 PDBj
PDBj















