+ データを開く
データを開く
- 基本情報
基本情報
| 登録情報 | データベース: PDB / ID: 2hy3 | ||||||
|---|---|---|---|---|---|---|---|
| タイトル | Crystal structure of the human tyrosine receptor phosphate gamma in complex with vanadate | ||||||
 要素 要素 | Receptor-type tyrosine-protein phosphatase gamma | ||||||
 キーワード キーワード |  HYDROLASE (加水分解酵素) / twisted mixed beta-sheets flanked by {alpha}-helices / HYDROLASE (加水分解酵素) / twisted mixed beta-sheets flanked by {alpha}-helices /  Structural Genomics (構造ゲノミクス) / PSI / Structural Genomics (構造ゲノミクス) / PSI /  Protein Structure Initiative / New York SGX Research Center for Structural Genomics / NYSGXRC Protein Structure Initiative / New York SGX Research Center for Structural Genomics / NYSGXRC | ||||||
| 機能・相同性 |  機能・相同性情報 機能・相同性情報negative regulation of epithelial cell migration /  transmembrane receptor protein tyrosine phosphatase activity / transmembrane receptor protein tyrosine phosphatase activity /  脱リン酸化 / 脱リン酸化 /  プロテインチロシンホスファターゼ / プロテインチロシンホスファターゼ /  protein tyrosine phosphatase activity / protein tyrosine phosphatase activity /  cell surface receptor protein tyrosine kinase signaling pathway / negative regulation of neuron projection development / extracellular exosome / identical protein binding / cell surface receptor protein tyrosine kinase signaling pathway / negative regulation of neuron projection development / extracellular exosome / identical protein binding /  細胞膜 細胞膜類似検索 - 分子機能 | ||||||
| 生物種 |   Homo sapiens (ヒト) Homo sapiens (ヒト) | ||||||
| 手法 |  X線回折 / X線回折 /  シンクロトロン / シンクロトロン /  単波長異常分散 / 解像度: 2.6 Å 単波長異常分散 / 解像度: 2.6 Å | ||||||
 データ登録者 データ登録者 | Jin, X. / Min, T. / Bera, A. / Mu, H. / Sauder, J.M. / Freeman, J.C. / Reyes, C. / Smith, D. / Wasserman, S.R. / Burley, S.K. ...Jin, X. / Min, T. / Bera, A. / Mu, H. / Sauder, J.M. / Freeman, J.C. / Reyes, C. / Smith, D. / Wasserman, S.R. / Burley, S.K. / Shapiro, L. / New York SGX Research Center for Structural Genomics (NYSGXRC) | ||||||
 引用 引用 |  ジャーナル: J.STRUCT.FUNCT.GENOM. / 年: 2007 ジャーナル: J.STRUCT.FUNCT.GENOM. / 年: 2007タイトル: Structural genomics of protein phosphatases. 著者: Almo, S.C. / Bonanno, J.B. / Sauder, J.M. / Emtage, S. / Dilorenzo, T.P. / Malashkevich, V. / Wasserman, S.R. / Swaminathan, S. / Eswaramoorthy, S. / Agarwal, R. / Kumaran, D. / Madegowda, M. ...著者: Almo, S.C. / Bonanno, J.B. / Sauder, J.M. / Emtage, S. / Dilorenzo, T.P. / Malashkevich, V. / Wasserman, S.R. / Swaminathan, S. / Eswaramoorthy, S. / Agarwal, R. / Kumaran, D. / Madegowda, M. / Ragumani, S. / Patskovsky, Y. / Alvarado, J. / Ramagopal, U.A. / Faber-Barata, J. / Chance, M.R. / Sali, A. / Fiser, A. / Zhang, Z.Y. / Lawrence, D.S. / Burley, S.K. | ||||||
| 履歴 |
|
- 構造の表示
構造の表示
| 構造ビューア | 分子:  Molmil Molmil Jmol/JSmol Jmol/JSmol |
|---|
- ダウンロードとリンク
ダウンロードとリンク
- ダウンロード
ダウンロード
| PDBx/mmCIF形式 |  2hy3.cif.gz 2hy3.cif.gz | 121.9 KB | 表示 |  PDBx/mmCIF形式 PDBx/mmCIF形式 |
|---|---|---|---|---|
| PDB形式 |  pdb2hy3.ent.gz pdb2hy3.ent.gz | 100 KB | 表示 |  PDB形式 PDB形式 |
| PDBx/mmJSON形式 |  2hy3.json.gz 2hy3.json.gz | ツリー表示 |  PDBx/mmJSON形式 PDBx/mmJSON形式 | |
| その他 |  その他のダウンロード その他のダウンロード |
-検証レポート
| アーカイブディレクトリ |  https://data.pdbj.org/pub/pdb/validation_reports/hy/2hy3 https://data.pdbj.org/pub/pdb/validation_reports/hy/2hy3 ftp://data.pdbj.org/pub/pdb/validation_reports/hy/2hy3 ftp://data.pdbj.org/pub/pdb/validation_reports/hy/2hy3 | HTTPS FTP |
|---|
-関連構造データ
| 関連構造データ | 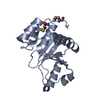 1rxdC  2fh7C  2g59C  2hcmC  2hhlC  2hxpC  2i0oC  2i1yC  2i44C  2iq1C  2irmC  2isnC  2nv5C  2oycC  2p27C  2p4uC  2p69C  2p8eC  2pbnC  2q5eC  2qjcC  2r0bC C: 同じ文献を引用 ( |
|---|---|
| 類似構造データ | |
| その他のデータベース |
- リンク
リンク
- 集合体
集合体
| 登録構造単位 | 
| ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 
| ||||||||||||||||||
| 2 | 
| ||||||||||||||||||
| 単位格子 |
| ||||||||||||||||||
| 非結晶学的対称性 (NCS) | NCSドメイン:
NCSドメイン領域: Component-ID: 1 / Ens-ID: 1 / Beg label comp-ID: GLU / End label comp-ID: GLY / Refine code: 4 / Auth seq-ID: 826 - 1122 / Label seq-ID: 9 - 305
|
- 要素
要素
| #1: タンパク質 | 分子量: 36417.207 Da / 分子数: 2 / 断片: residues 819-1130 / 由来タイプ: 組換発現 / 由来: (組換発現)   Homo sapiens (ヒト) / 遺伝子: PTPRG / プラスミド: pSGX4 / 生物種 (発現宿主): Escherichia coli / 発現宿主: Homo sapiens (ヒト) / 遺伝子: PTPRG / プラスミド: pSGX4 / 生物種 (発現宿主): Escherichia coli / 発現宿主:   Escherichia coli BL21(DE3) (大腸菌) / 株 (発現宿主): BL21(DE3) Escherichia coli BL21(DE3) (大腸菌) / 株 (発現宿主): BL21(DE3)参照: UniProt: P23470,  プロテインチロシンホスファターゼ プロテインチロシンホスファターゼ#2: 化合物 |  バナジン酸塩 バナジン酸塩#3: 水 | ChemComp-HOH / |  水 水 |
|---|
-実験情報
-実験
| 実験 | 手法:  X線回折 / 使用した結晶の数: 1 X線回折 / 使用した結晶の数: 1 |
|---|
- 試料調製
試料調製
| 結晶 | マシュー密度: 2.42 Å3/Da / 溶媒含有率: 49.09 % |
|---|---|
結晶化 | 温度: 293 K / 手法: 蒸気拡散法, ハンギングドロップ法 / pH: 8 詳細: 12% PEG3350, 0.1M Tris, 0.3M NaCl, pH 8.0, VAPOR DIFFUSION, HANGING DROP, temperature 293K |
-データ収集
| 回折 | 平均測定温度: 100 K |
|---|---|
| 放射光源 | 由来:  シンクロトロン / サイト: シンクロトロン / サイト:  NSLS NSLS  / ビームライン: X4A / 波長: 0.97891 Å / ビームライン: X4A / 波長: 0.97891 Å |
| 検出器 | タイプ: ADSC QUANTUM 4 / 検出器: CCD / 日付: 2006年7月16日 |
| 放射 | モノクロメーター: Si(111) / プロトコル: SINGLE WAVELENGTH / 単色(M)・ラウエ(L): M / 散乱光タイプ: x-ray |
| 放射波長 | 波長 : 0.97891 Å / 相対比: 1 : 0.97891 Å / 相対比: 1 |
| 反射 | 解像度: 2.6→50 Å / Num. all: 24687 / Num. obs: 20061 / % possible obs: 87 % / Observed criterion σ(F): 1 / Observed criterion σ(I): 2 |
| 反射 シェル | 解像度: 2.6→2.69 Å / % possible all: 89 |
- 解析
解析
| ソフトウェア |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 精密化 | 構造決定の手法 : :  単波長異常分散 / 解像度: 2.6→17 Å / Cor.coef. Fo:Fc: 0.94 / Cor.coef. Fo:Fc free: 0.882 / SU B: 25.526 / SU ML: 0.265 / TLS residual ADP flag: LIKELY RESIDUAL / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R Free: 0.426 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: Used weighted full matrix least squares procedure. 単波長異常分散 / 解像度: 2.6→17 Å / Cor.coef. Fo:Fc: 0.94 / Cor.coef. Fo:Fc free: 0.882 / SU B: 25.526 / SU ML: 0.265 / TLS residual ADP flag: LIKELY RESIDUAL / 交差検証法: THROUGHOUT / σ(F): 0 / ESU R Free: 0.426 / 立体化学のターゲット値: MAXIMUM LIKELIHOOD / 詳細: Used weighted full matrix least squares procedure.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 溶媒の処理 | イオンプローブ半径: 0.8 Å / 減衰半径: 0.8 Å / VDWプローブ半径: 1.4 Å / 溶媒モデル: MASK | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子変位パラメータ | Biso mean: 40.551 Å2
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化ステップ | サイクル: LAST / 解像度: 2.6→17 Å
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 拘束条件 |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Refine LS restraints NCS | Dom-ID: 1 / Auth asym-ID: A / Ens-ID: 1 / 数: 2217 / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LS精密化 シェル | 解像度: 2.6→2.666 Å / Total num. of bins used: 20
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLS | 手法: refined / Refine-ID: X-RAY DIFFRACTION
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 精密化 TLSグループ |
|
 ムービー
ムービー コントローラー
コントローラー













 PDBj
PDBj